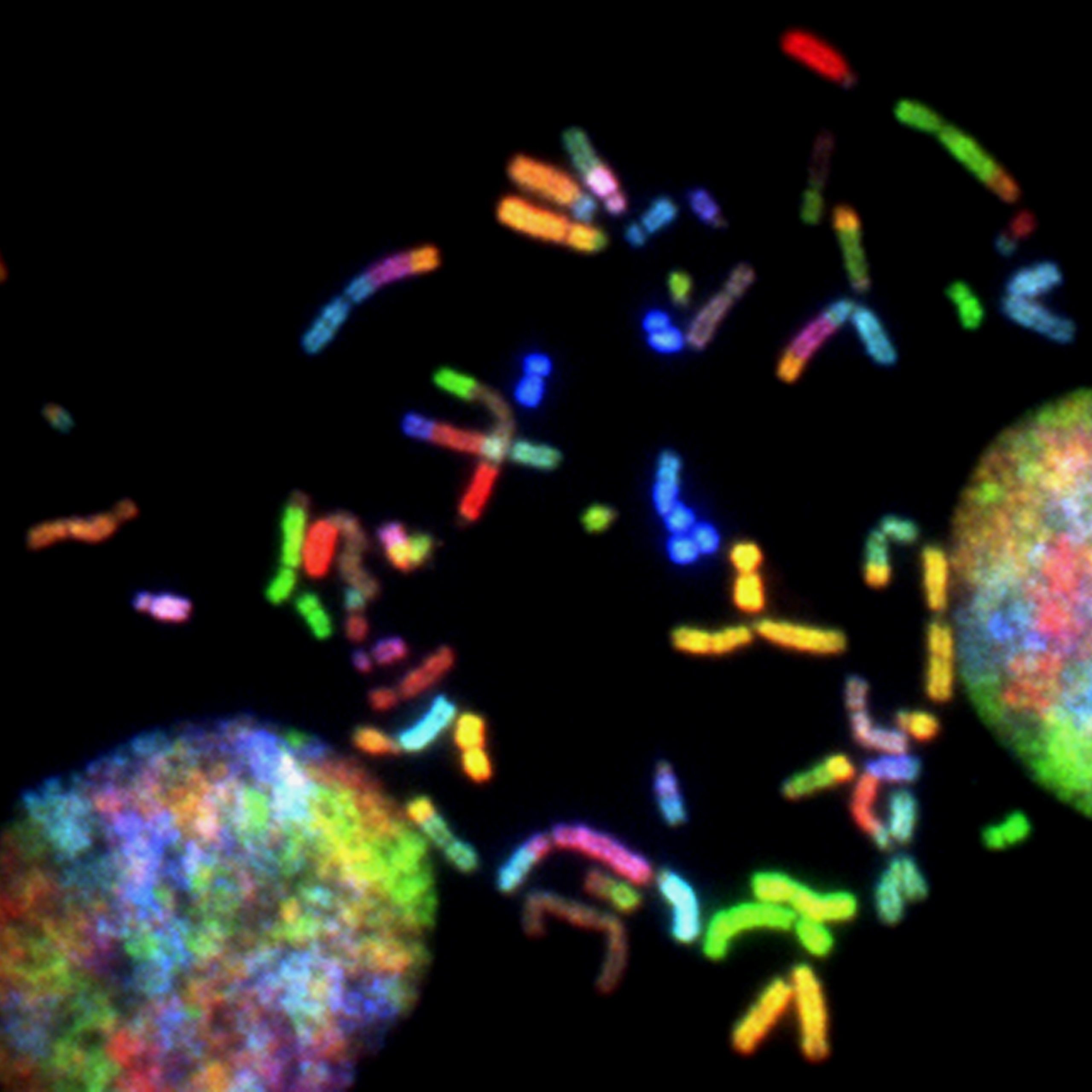Odkrycie metod pozwalających żyć wiecznie jest utopią każdego naukowca związanego z biologią. Branża anti-aging aktywnie się rozwija, więc pojawiają się nowe perspektywiczne projekty i, przede wszystkim obiekty badan takie, jak telomery. Telomery były kiedyś niejasnymi elementami funkcjonalnymi na końcach chromosomów, badanymi przez kilku naukowców. Badania nad telomerami stały się obecnie prawie mainstreamem, a na ten temat opublikowano znacznie więcej artykułów naukowych niż parę lat temu.
Wprowadzenie
Starzenie się można zdefiniować jako postępujący funkcjonalny spadek funkcji tkanek, który ostatecznie prowadzi do śmierci. Taki spadek funkcji może wynikać z utraty lub zmniejszonej funkcji komórek post mitotycznych lub z niemożności zastąpienia takich komórek przez funkcjonalny spadek zdolności komórek (macierzystych) do podtrzymywania replikacji i podziałów komórkowych.
W ciągu ostatnich trzech dekad pole starzenia się uległo znacznej ekspansji wraz z odkryciem, że jest kontrolowane, przynajmniej do pewnego stopnia, przez ewolucyjnie zachowane szlaki [10]. Podstawowymi cechami przyczynowymi są niestabilność genomowa, uszkodzenie telomerów i zmiany epigenetyczne, które częściowo nakładają się lub przeplatają ze sobą. Na przykład uszkodzenie telomerów prowadzi również do niestabilności genomu [10].
DNA znajduje się w jądrach komórek, gdzie jest powiązane ze strukturami zwanymi chromosomami. Każdy chromosom zawiera określoną informację genetyczną w postaci genów. Gdy komórki w ciele dzielą się, chromosomy muszą się replikować, aby każda komórka zawierała pełny zestaw chromosomów w swoim jądrze. Na końcach każdego z chromosomów znajdują się odcinki DNA zwane telomerami. Więc z tego – definicja: telomery to struktury z powtarzającymi się sekwencjami nukleotydowymi i określonymi białkami wiążącymi na końcach chromosomów eukariotycznych [7].
Telomeraza to enzym, który dodaje więcej nukleotydów do końca telomeru, wydłużając go. Pozwala to komórkom dzielić się i rosnąć dłużej. Większość typów komórek w ciele nie ma telomerazy. Oznacza to, że większość telomerów z czasem ulega skróceniu. W tkankach dorosłych nie ma wystarczającej ilości telomerazy, aby nadążyć za podziałem komórek. Stopniowo, w ciągu naszego życia, telomery stają się coraz krótsze, a coraz więcej naszych komórek starzeje się. W związku z tym osoby starsze nie mogą kontynuować wzrost i regenerować swoich tkanek tak skutecznie, jak osoby młodsze.
 Resveratrol od Apollo’s Hegemony – jeden z najlepszych suplementów przeciwstarzeniowych – KUP TUTAJ
Resveratrol od Apollo’s Hegemony – jeden z najlepszych suplementów przeciwstarzeniowych – KUP TUTAJ
Znaczenie długości telomerów
W ciągu ostatniej dekady nastąpił znaczny wzrost zakresu i głębi zrozumienia wielorakich ról biologii telomerów w chorobach człowieka [1].
Jaki wpływ ma skrócenie telomerów na poziomie tkanek lub całego organizmu? Czy starzenie się powoduje skrócenie telomerów, czy skrócenie telomerów powoduje starzenie się? Kwestia starzenia się organizmu w wyniku krótkich telomerów została rozpatrywana jako problem, gdy owca Dolly została „sklonowana” przez przeniesienie jądra dorosłego gruczołu sutkowego do wyłuszczonego jajeczka, zauważono, że miała ona krótsze telomery [22].
Średnia długość telomerów przy urodzeniu (w USA) wynosi ~9,5 kb [21]. Następnie ta długość skraca się o ~2 kb w 3 dekadzie życia i o ~3,5 kb w 9 dekadzie życia.
U ludzi długość telomerów we krwi wykazuje korelację ze zdrowiem i długością życia osób w wieku 60 lat lub starszych. W ludzkich jądrzastych krwinkach średnia długość telomerów wykazuje wraz z wiekiem bardzo znaczący spadek, co jest najbardziej widoczne dla komórek układu odpornościowego. Wykazano jednak również, że przy przewidywaniu długości życia liczy się odsetek krótkich telomerów, a nie średnia długość telomerów [6]. Telomery zapobiegają pojawianiu się końców chromosomów liniowych w wyniku pękania podwójnej nici DNA i chronią końce chromosomów przed degradacją i fuzją.
Ludzi z pierwotnymi zaburzeniami mitochondrialnymi (takimi jak choroby spowodowane mutacjami w genomie mitochondrialnym) i wtórnymi dysfunkcjami (takimi jak choroby metaboliczne, choroby neurodegeneracyjne i inne również mają krótsze telomery w porównaniu do osób zdrowych [4]. Badania przeprowadzone na bardzo zestresowanych kobietach i osobach z poważnymi zaburzeniami depresyjnymi pokazują również korelację między dysfunkcją mitochondriów, stresem oksydacyjnym i skracaniem telomerów [5].
Inne czynniki związane ze stylem życia, takie jak palenie, otyłość i brak ruchu, zwiększają tempo skracania telomerów. W metaanalizie opartej na 84 badaniach stwierdzono, że palacze mieli krótsze telomery niż osoby niepalące [19]. Wykazano, że różne aspekty statusu społeczno-ekonomicznego, w szczególności poziom wykształcenia i wsparcie społeczne, wpływają na długość telomerów [20]. W badaniu opartym na 84 996 ludzi pochodzenia nielatynoskiego osoby o niskim statusie społeczno-ekonomicznym miały krótkie telomery [21].
Pęknięcia jednoniciowe preferencyjnie gromadzą się w telomerach w warunkach łagodnego stresu oksydacyjnego, co powoduje blokowanie widełek replikacyjnych i niepełną replikację końców chromosomów, co ponownie prowadzi do skracania telomerów [25]. Ekspozycja środowiskowa na promieniowanie ultrafioletowe i jonizujące oraz narażenie na czynniki rakotwórcze, takie jak arsen i ołów, powodują uszkodzenia DNA bezpośrednio lub pośrednio poprzez indukcję uszkodzeń oksydacyjnych lub początek przewlekłego zapalenia [25,26].
Ze względu na niepełną syntezę opóźnionej nici DNA, uszkodzenia oksydacyjne i inne czynniki, postępujące skracanie telomerów ostatecznie skutkuje zatrzymaniem wzrostu komórkowego i zostało zaproponowane jako początkowa bariera proliferacyjna dla powstawania nowotworu [2]. Związek między długością telomerów a ryzykiem raka opisano w kilku badaniach epidemiologicznych [23]. Badania prowadzone w dużych kohortach konsekwentnie wykazywały związek między wydłużeniem telomerów a ryzykiem różnych nowotworów, w tym czerniaka, glejaka, raka płuc, guzów układu moczowo-płciowego i chłoniaka [24]. Jednakże, gdy zatrzymanie wzrostu zainicjowane przez kilka skróconych telomerów zostanie ominięte z powodu utraty supresorów (spowalniaczy) nowotworowych i zmian onkogennych, telomery mogą nadal się skracać, ostatecznie prowadząc do cykli pękania mostków chromosomowych, co może skutkować niestabilnością genomu i zwiększonym ryzykiem raka [3].
Niezwykle krótkie telomery, spowodowane wadliwymi komponentami, które chronią lub wydłużają telomery z powodu mutacji genetycznych, powodują różne wyniszczające zaburzenia, zwane telomeropatiami
Jak wydłużyć telomery?
Wydaje się, że jedynym sposobem spowolnienia starzenia się jest ograniczenie kalorii. W jądrze komórki restrykcja kaloryczna zwiększa naprawę DNA i łagodzi erozję telomerów [9]. Rozpatrzymy również alternatywne metody, jakie mogą wpłynąć na długość telomerów i starzenie.
Dieta
Osoby o zdrowszej diecie mają zwykle dłuższe telomery, mniejsze ryzyko chorób przewlekłych i dłuższą żywotność. Niedawna metaanaliza z 2019 roku [37] zawiera ponad 20 badań – zarówno obserwacyjnych, jak i interwencyjnych – w celu zbadania związku między dietą a długością telomerów. Naukowcy odkryli, że przestrzeganie diety śródziemnomorskiej lub diety bogatej w rośliny było powiązane z dłuższymi telomerami. Patrząc na pojedyncze produkty spożywcze, nierafinowane ziarna, orzechy i nasiona kojarzyły się z dłuższymi telomerami. Naukowcy odkryli również, że dieta bogata w karotenoidy, składnik odżywczy znajdujący się w zielonych liściach i czerwono-pomarańczowych owocach i warzywach, była znacząco powiązana z dłuższym telomerem. Badanie z 2018 roku [38] z udziałem ponad 5000 osób dorosłych wykazało, że spożywanie większej ilości błonnika wiązało się z większą długością telomerów. Może to wynikać ze zdolności błonnika do kontrolowania poziomu glukozy we krwi.
Aktywność fizyczna
Zarówno aktywność fizyczna, jak i ćwiczenia pomagają zachować długość telomerów.[2] Jedno badanie przeprowadzone w ramach National Health and Nutrition Examination Survey (NHANES) przebadało ponad 5000 osób i wykazało, że osoby, które ćwiczą częściej, mają dłuższe telomery niż osoby prowadzące bardziej siedzący tryb życia. Aktywność fizyczna pomaga zmniejszyć stres oksydacyjny i stany zapalne w organizmie, pomagając chronić telomery przed uszkodzeniem. Co więcej, aktywność telomerazy – enzymu, który pomaga utrzymać długość telomerów – może również wzrosnąć u bardziej aktywnych osób. Werner i in. zbadali aktywność telomerów wśród sportowców i odkryli, że sportowcy mieli zwiększoną aktywność telomerazy i zmniejszyli skracanie telomerów w porównaniu do osób niebędących sportowcami.[3]
Kawa
Spożywanie kawy wiąże się z wieloma schorzeniami i niższym ryzykiem śmierci [14]. Kawa zawiera wiele przeciwutleniaczy, w tym kofeinę, kwas chlorogenowy, diterpeny, melanoidyny i polifenole. W populacjach, które regularnie spożywają kawę, jest ona głównym źródłem spożycia przeciwutleniaczy i stanowi wysoki procent całkowitej zdolności antyoksydacyjnej diety. Badania wykazały, że kawa i jej składniki mogą chronić przed uszkodzeniem DNA [15,16].
W obszernym badaniu [17] z udziałem 4780 osób wykazano statystycznie istotną tendencję liniową z dłuższymi telomerami w przypadku spożycia kawy z kofeiną, ale nie w przypadku kawy bezkofeinowej.
 Naturalne źródło kofeiny – guarana – KUP TUTAJ
Naturalne źródło kofeiny – guarana – KUP TUTAJ
Zarządzanie stresem
Kiedy jesteśmy zestresowani, ciało uwalnia hormony, które mogą powodować stres oksydacyjny. Może to spowodować większe uszkodzenia DNA i skrócenie telomerów. Na podstawie tych informacji zmniejszenie stresu powinno pomóc w zmniejszeniu stresu oksydacyjnego — a badania pokazują, że tak jest. Badanie z 2004 r. [39] dotyczyło kobiet, które opiekowały się przewlekle chorym dzieckiem, co może znacznie zwiększyć poziom stresu. Te kobiety miały krótsze telomery, zmniejszoną aktywność telomerazy i większy stres oksydacyjny w porównaniu z grupą kobiet opiekujących się zdrowymi dziećmi. Badanie z 2016 r. [40] oceniało mężczyzn i kobiety, którzy byli narażeni na stresory. Ci, którzy zareagowali wzrostem kortyzolu, głównego hormonu stresu, mieli zwiększone skrócenie telomerów przez kilka lat.
Witamina D3
Richards i in. [31] wykazali dodatni związek między stężeniem witaminy D w surowicy a długością telomerów w leukocytach obwodowych u kobiet. Biologicznie aktywna forma witaminy D, 1α,25-dihydroksywitamina D3, ma właściwości immunosupresyjne. Znajduje to odzwierciedlenie w odwrotnej zależności między stężeniem witaminy D w osoczu a markerem zapalenia CRP [32]. Długość telomerów jest ujemnie skorelowana ze stężeniem CRP w osoczu [33]. Ponadto witamina D zmniejsza również ekspresję mediatorów stanu zapalnego, interleukiny-2 i interferonu gamma. Te przeciwzapalne i antyproliferacyjne właściwości witaminy D ograniczają obrót komórek, potencjalnie zmniejszając w ten sposób utratę długości telomerów.
Witamina D3 rozpuszczona w oliwie – KUP TUTAJ
Luteina, zeaksantyna i witamina C
Powyższe związki posiada silne działanie przeciwutleniające. W badaniu Sen i wsp. [18] po uzyskaniu danych zrobiono wielokrotne analizy regresji liniowej z uwzględnieniem wieku i płci, które wykazały, że wyższe stężenia luteiny, zeaksantyny i witaminy C były silnie związane z większą długością telomerów. Związki te były niezależne od wskaźnika masy ciała, maksymalnego poboru tlenu i naczyniowych czynników ryzyka i nie były pośredniczone przez zawartość zaawansowanych produktów utleniania białek.
Uważaj na żelazo
W przeciwieństwie do działania innych składników odżywczych, stosowanie suplementów żelaza wiąże się z krótszymi telomerami [27,28]. Żelazo jest prooksydantem, który może wiązać się z resztami cysteinowymi białek i powodować powstawanie wolnych rodników hydroksylowych [29]. Wykazano, że przyjmowanie suplementów żelaza zwiększa wydalanie wolnych rodników z kałem u zdrowych osób [30]. Krótsze telomery obserwowane u użytkowników suplementów żelaza mogą być spowodowane zdolnością żelaza do generowania wolnych rodników i wynikającym z tego stresem oksydacyjnym [28]. Spożycie żelaza z diety lub multiwitamin, które mogą zawierać mniej żelaza niż suplementy z nim, nie jest ujemnie związane z długością telomerów [27].
Wprowadzenie RNA z TERT
TERT jest aktywnym składnikiem telomerazy – enzymu wyrażanego przez komórki macierzyste, który utrzymuje zdrowie telomerów, gdy są one przekazywane następnemu pokoleniu. Chociaż komórki macierzyste wyrażają TERT, naukowcy zauważają, że większość innych typów komórek nie.
W badaniach z 2015 roku [34] naukowcy wyjaśniają, że wprowadzenie zaledwie trzech aplikacji zmodyfikowanego RNA (zwanego zmodyfikowanym TERT mRNA) do komórek ludzkich w ciągu kilku dni zwiększyło długość telomerów nawet o 10%. Zespół zauważa, że młodzi ludzie posiadają telomery o długości około 8 000-10 000 nukleotydów, ale zmodyfikowany RNA kodujący TERT zwiększył długość telomerów o około 1000 nukleotydów.
Co więcej, naukowcy twierdzą, że ludzkie komórki skóry traktowane zmodyfikowanym mRNA TERT podzieliły się około 28 razy więcej niż te, które pozostały nieleczone, podczas gdy leczone ludzkie komórki mięśniowe podzieliły się około trzy razy więcej.
Źródła
- Savage SA. Beginning at the ends: telomeres and human disease [version 1; peer review: 4 approved]. F1000Research 2018, 7(F1000 Faculty Rev):524
- Shay JW: Role of telomeres and telomerase in aging and cancer. Cancer Discov 2016, 6:584-593
- Shay J, Wright WE, Werbin H: Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta 1991, 1072:1-7
- Gonzales-Ebsen, A. C., Gregersen, N., and Olsen, R. K. (2017). Linking telomere loss and mitochondrial dysfunction in chronic disease. Biosci. 22:117– 127
- Lindqvist, D., Epel, E. S., Mellon, S. H., Penninx, B. W., Revesz, D., Verhoeven, J. E., et al. (2015). Psychiatric disorders and leukocyte telomere length: underlying mechanisms linking mental illness with cellular aging. Biobehav. Rev. 55, 333–364
- Cawthon, R. M., Smith, K. R., O’Brien, E., Sivatchenko, A., and Kerber, R. A. (2003). Association between telomere length in blood and mortality in people aged 60 years or older. Lancet 361, 393–395
- de Lange, T. (2005). Shelterin: the protein complex that shapes and safeguards human telomeres. Genes Dev. 19, 2100–2110
- Madeo, F., Carmona-Gutierrez, D., Hofer, S. J., and Kroemer, G. (2019). Caloric restriction mimetics against age-associated disease: targets, mechanisms, and therapeutic potential. Cell Metab. 29, 592–610.
- Szafranski, K., and Mekhail, K. (2014). The fine line between lifespan extension and shortening in response to caloric restriction. Nucleus 5, 56–65. doi: 10.4161/ nucl.27929
- Zheng, Q., Huang, J., & Wang, G. (2019). Mitochondria, Telomeres and Telomerase Subunits. Frontiers in Cell and Developmental Biology, 7(November), 1–10.
- Wu Z, McGoogan JM. Characteristics of and important lessons from the Coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72314 cases from the Chinese center for disease control and prevention. JAMA. 2020;323(13):1239.
- Dong Y, Mo X, Hu Y, et al. Epidemiological characteristics of 2143 pediatric patients with 2019 Coronavirus disease in China. Pediatrics. 2020:e20200702
- Aviv A, Shay JW. Reflections on telomere dynamics and ageing-related diseases in humans. Philos Trans R Soc B Biol Sci. 2018;373(1741):20160436.
- Butt MS, Sultan MT. Coffee and its consumption: benefits and risks. Crit Rev Food Sci Nutr 2011;51:363–73
- Bakuradze T, Lang R, Hofmann T, Eisenbrand G, Schipp D, Galan J, Richling E. Consumption of a dark roast coffee decreases the level of spontaneous DNA strand breaks: a randomized controlled trial. Eur J Nutr 2015;54:149–56.
- Cavin C, Mace K, Offord EA, Schilter B. Protective effects of coffee diterpenes against aflatoxin B1-induced genotoxicity: mechanisms in rat and human cells. Food Chem Toxicol 2001;39:549–56.
- Liu JJ, Crous-Bou M, Giovannucci E, De Vivo I. Coffee Consumption Is Positively Associated with Longer Leukocyte Telomere Length in the Nurses’ Health Study. J Nutr.
- Sen A, Marsche G, Freudenberger P, Schallert M, Toeglhofer AM, Nagl C, Schmidt R, Launer LJ, Schmidt H. Association between higher plasma lutein, zeaxanthin, and vitamin C concentrations and longer telomere length: results of the Austrian Stroke Prevention Study. J Am Geriatr Soc. 2014 Feb;62(2):222-9.
- Astuti, Y.; Wardhana, A.; Watkins, J.; Wulaningsih, W.; Network, P.R. Cigarette smoking and telomere length: A systematic review of 84 studies and meta-analysis. Environ. Res. 2017, 158, 480–489
- Carroll, J.E.; Diez Roux, A.V.; Fitzpatrick, A.L.; Seeman, T. Low social support is associated with shorter leukocyte telomere length in late life: Multi-ethnic study of atherosclerosis. Psychosom. Med. 2013, 75, 171–177.
- Alexeeff, S.E.; Schaefer, C.A.; Kvale, M.N.; Shan, J.; Blackburn, E.H.; Risch, N.; Ranatunga, D.K.; Jorgenson, E.; Hoffmann, T.J.; Sakoda, L.C.; et al. Telomere length and socioeconomic status at neighborhood and individual levels among 80,000 adults in the genetic epidemiology research on adult health and aging cohort. Environ. Epidemiol. 2019, 3, e049.
- Shiels PG, Kind AJ, Campbell KH, Wilmut I, Waddington D, Colman A, Schnieke AE. Analysis of telomere length in Dolly, a sheep derived by nuclear transfer. Cloning 1: 119–125, 1999.
- Caini, S.; Raimondi, S.; Johansson, H.; De Giorgi, V.; Zanna, I.; Palli, D.; Gandini, S. Telomere length and the risk of cutaneous melanoma and non-melanoma skin cancer: A review of the literature and meta-analysis. J. Dermatol. Sci. 2015, 80, 168–174
- Haycock, P.C.; Burgess, S.; Nounu, A.; Zheng, J.; Okoli, G.N.; Bowden, J.; Wade, K.H.; Timpson, N.J.; Evans, D.M.; Willeit, P.; et al. Association between telomere length and risk of cancer and non-neoplastic diseases: A mendelian randomization study. JAMA Oncol. 2017, 3, 636–651
- Borghini, A.; Faita, F.; Mercuri, A.; Minichilli, F.; Bustaffa, E.; Bianchi, F.; Andreassi, M.G. Arsenic exposure, genetic susceptibility and leukocyte telomere length in an italian young adult population. Mutagenesis 2016, 31, 539–546.
- Barnes, R.P.; Fouquerel, E.; Opresko, P.L. The impact of oxidative DNA damage and stress on telomere homeostasis. Mech. Ageing Dev. 2019, 177, 37–45
- Xu Q, Parks CG, DeRoo LA, Cawthon RM, Sandler DP, Chen H. Multivitamin use and telomere length in women. Am J Clin Nutr 2009;89:1857–63
- Aviv A. Leukocyte telomere length: the telomere tale continues. Am J Clin Nutr 2009;89:1721
- Searle AJF, Tomasi A. Hydroxyl free radical production in iron-cysteine solutions and protection by zinc. J Inorg Biochem 1982;17:161–6.
- Lund EK, Wharf SG, Fairweather-Tait SJ, Johnson IT. Oral ferrous sulfate supplements increase the free radical-generating capacity of feces from healthy volunteers. Am J Clin Nutr 1999;69:250–5.
- Richards JB, Valdes AM, Gardner JP, Paximadas D, Kimura M, Nessa A, et al. Higher serum vitamin D concentrations are associated with longer leukocyte telomere length in women. Am J Clin Nutr 2007;86:1420–5.
- Oelzner P, Muller A, Deschner F, Huller M, Abendroth K, Hein G, et al. Relationship between disease activity and serum levels of vitamin D metabolites and PTH in rheumatoid arthritis. Calcif Tissue Int 1998;62:193–8.
- Aviv A, Valdes A, Gardner JP, Swaminathan R, Kimura M, Spector TD. Menopause modifies the association ofleukocyte telomere length with insulin resistance and inflammation. J Clin Endocrinol Metab 2006;91:635–40.
- Ramunas J, Yakubov E, Brady JJ, et al. Transient delivery of modified mRNA encoding TERT rapidly extends telomeres in human cells. FASEB J. 2015;29(5):1930-1939. doi:10.1096/fj.14-259531
- Arsenis NC, You T, Ogawa EF, Tinsley GM, Zuo L. Physical activity and telomere length: Impact of aging and potential mechanisms of action. Oncotarget. 2017;8(27):45008-45019. doi:10.18632/oncotarget.16726
- Werner C, Fürster T, Widmann T, Pöss J, Roggia C, Hanhoun M, Scharhag J, Büchner N, Meyer T, Kindermann W, Haendeler J, Böhm M, Laufs U. Physical exercise prevents cellular senescence in circulating leukocytes and in the vessel wall. Circulation. 2009 Dec 15;120(24):2438-47.
- Crous-Bou M, Molinuevo JL, Sala-Vila A. Plant-Rich Dietary Patterns, Plant Foods and Nutrients, and Telomere Length. Adv Nutr. 2019;10(Suppl_4):S296-S303. doi:10.1093/advances/nmz026
- Tucker LA. Dietary Fiber and Telomere Length in 5674 U.S. Adults: An NHANES Study of Biological Aging. Nutrients. 2018;10(4):400. Published 2018 Mar 23. doi:10.3390/nu10040400
- Epel ES, Blackburn EH, Lin J, et al. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci U S A. 2004;101(49):17312-17315. doi:10.1073/pnas.0407162101
- Steptoe A, Hamer M, Lin J, Blackburn EH, Erusalimsky JD. The Longitudinal Relationship Between Cortisol Responses to Mental Stress and Leukocyte Telomere Attrition. J Clin Endocrinol Metab. 2017;102(3):962-969. doi:10.1210/jc.2016-3035