Obrazek wyróżniający: CHUTTERSNAP
Aktywność fizyczna bez wątpienia niesie za sobą wiele korzyści zdrowotnych. Pomaga w utrzymaniu odpowiedniej masy ciała, wydolności fizycznej, a także kondycji psychicznej. Z wysiłkiem fizycznym związane będą również exerkiny – związki, które są uwalniane z wielu narządów, tkanek i komórek organizmu i wywierają działanie auto-, para- lub endokrynologiczne. Exerkiny są uwalniane z mięśni szkieletowych (miokiny), serca (kardiokiny), wątroby (hepatokiny), białej tkanki tłuszczowej (adipokiny), brązowej tkanki tłuszczowej (baptokiny) i neuronów (neurokiny). Wykazano, że wiele z tych exerkin w izolowanych komórkach mięśniowych i modelach szczurzych potencjalnie reguluje syntezę białek mięśniowych, unaczynienie, mitochondria biogeneza, naprawa i przebudowa mięśni oraz przebudowa serca oraz neuroprotekcja w hipokampie.
 Kreatyna od Testosterone.pl – zwiększa zdolności wysiłkowe sportowca – KUP TUTAJ
Kreatyna od Testosterone.pl – zwiększa zdolności wysiłkowe sportowca – KUP TUTAJ
Osteoartroza
Choroba zwyrodnieniowa stawów (osteoartroza, OA) jest częstą i wyniszczającą chorobą, stanowiącą stale rosnące i znaczne obciążenie dla zdrowia, mającą głębokie konsekwencje dla poszczególnych osób, systemów opieki zdrowotnej i szerszych sfer społeczno-ekonomicznych. Szacuje się, że koszty choroby zwyrodnieniowej stawów w Stanach Zjednoczonych, Kanadzie, Wielkiej Brytanii, Francji i Australii stanowią od 1% do 2,5% produktu narodowego brutto tych krajów. Dane z kanadyjskiej kohorty wykazały, że średni roczny koszt na pacjenta z chorobą zwyrodnieniową stawów wynosił 12 200 dolarów. Pierwotna choroba zwyrodnieniowa stawów wynika z połączenia czynników ryzyka, takich jak genetyka, dieta, estrogeny, gęstość kości, przy czym najbardziej widoczne są wiek i otyłość. Na całym świecie, ze względu na starzenie się populacji, częstość występowania choroby zwyrodnieniowej stawów wzrosła o 113,25%, z 247,51 miliona w 1990 r. do 527,81 miliona przypadków w 2019 r. Szacuje się, że na całym świecie 240 milionów osób cierpi na objawową chorobę zwyrodnieniową stawów związaną z ograniczoną ruchomością, przy czym to często kolano ulega uszkodzeniu i jest najczęściej dotkniętym tą chorobą stawem. Około 30% osób w wieku powyżej 45 lat wykazuje radiograficzne objawy choroby zwyrodnieniowej stawu kolanowego, a u połowy z nich występują objawy związane z tą chorobą. Osteoartroza objawia się patologicznymi zmianami w chrząstce, kości, błonie maziowej, ścięgnach, mięśniach i okołostawowej tkance tłuszczowej, powodując dysfunkcję stawów, ból, sztywność, upośledzenie czynnościowe i utratę kluczowych czynności związanych z aktywnością fizyczną [1]. Obecne podejścia terapeutyczne obejmują przede wszystkim leki oraz terapie, takie jak niesteroidowe leki przeciwzapalne i endoprotezoplastyka stawów w zaawansowanym stadium choroby (operacja polegająca na umiejscowieniu sztucznych stawów w ciele człowieka), jednak strategie te w dużej mierze zapewniają złagodzenie objawów [2]. Ponadto wykazano, że niesteroidowe leki zapalne są powiązane ze zdarzeniami niepożądanymi ze strony przewodu pokarmowego, układu krążenia, nerek, hematologii i wątroby, co może stanowić pewien problem w komforcie życia pacjentów dotkniętych tą chorobą [3]. Endoprotezję stawu stosuje się wyłącznie w przypadku ciężkiej, schyłkowej fazy choroby zwyrodnieniowej stawów, co wiąże się z dużym obciążeniem finansowym, stresem związanym z zabiegiem chirurgicznym i oczywiście bólem dla pacjentów. W najnowszych wytycznych klinicznych coraz częściej zaleca się interwencje niechirurgiczne, takie jak ćwiczenia fizyczne, jako leczenie pierwszego rzutu. Terapia ruchowa, uznawana za bezpieczną i skuteczną, zyskuje coraz większą akceptację, a Światowa Organizacja Zdrowia zaleca 150–300 minut aktywności fizycznej o umiarkowanej intensywności lub 75–150 minut aktywności fizycznej o wysokiej intensywności tygodniowo u pacjentów z wczesną chorobą zwyrodnieniową stawów [4]. W ciągu ostatniej dekady coraz większa liczba dowodów potwierdziła istotny wpływ aktywności fizycznej, zwłaszcza aktywności o umiarkowanej intensywności, na osteoartroze, potwierdzając pogląd, że „ćwiczenia to prawdziwa pigułka zdrowia”, opierający się na czynnikach peryferyjnych wywołanych przez narządy [1]. Ogólnie rzecz biorąc, terapeutyczny wpływ ćwiczeń na chorobę zwyrodnieniową stawów przypisuje się powtarzającym się sesjom ćwiczeń, co sugeruje związek z skumulowanymi ostrymi reakcjami na aktywność fizyczną. Centralne miejsce w tej dyskusji zajmuje koncepcja „exerkin” obejmujących peptydy, mikroRNA, mRNA lub inne krążące gatunki RNA uwalniane do krwioobiegu w odpowiedzi na ćwiczenia [5]. Exerkiny obejmują różne jednostki sygnalizacyjne wydzielane po wysiłku, działające poprzez szlaki hormonalne, parakrynne i/lub autokrynne. Analiza ta rozszerza klasyfikację exerkin o czynniki humoralne związane z wysiłkiem fizycznym, w tym miokiny (mięśnie), kardiokiny (serce) i adipokiny (biała tkanka tłuszczowa; WAT). W szczególności exerkinami można nazwać wyłącznie kinezy regulowane przez ćwiczenia. Ostatnio na pierwszy plan wysunęła się kluczowa rola ćwiczeń fizycznych jako bezpośredniego modulatora wzmacniającego ogólne aspekty fizjologiczne związane z osteoartrozą, podkreślając funkcję exerkin w tym zakresie. Zrozumienie mechanistycznej zmienności reakcji na ćwiczenia i ich roli pośredniczącej w terapii ruchowej choroby ma ogromne znaczenie i wymaga dalszego badania zaangażowanych procesów i mechanizmów.
Jia i in, 2023 [1], Wysiłek fizyczny i exerkiny
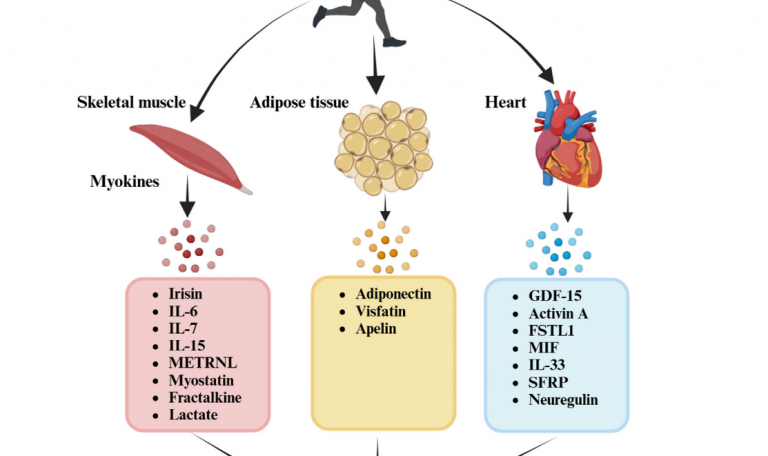
Miokiny
Bazując na powyższym obrazku, miokiny to związki, które pod wpływem aktywności fizycznej będą wytwarzane przez nasze mięśnie szkieletowe. Mięśnie szkieletowe, największy organ ciała, są bez wątpliwości ściśle powiązane z aktywnością fizyczną. Niedawno uznano, że mięśnie szkieletowe są narządem wydzielniczym, który wytwarza i uwalnia cytokiny zwane „miokinami”. Te miokiny – cytokiny lub peptydy wytwarzane przez komórki mięśni szkieletowych – przedostają się do krążenia, wpływając na inne komórki, tkanki lub narządy poprzez działanie autokrynne, parakrynne lub hormonalne. Kilka miokin, w tym iryzyna, interleukina-6 (IL-6), interleukina-15 (IL-15), meteorynopodobne (METRNL) i kwas β-aminoizomasłowy (BAIBA), są konsekwentnie uwalniane przez SkM w odpowiedzi na wysiłek fizyczny, odgrywają kluczową rolę w pośredniczeniu w korzystnym wpływie aktywności fizycznej [1]. W 2012 roku [6] naukowcy odkryli, że ćwiczenie fizyczne stymuluje mięśnie do wydzielania iryzyny, hormonopodobnego polipeptydu pochodzącego z rozszczepienia białka 5 zawierającego domenę fibronektyny typu III (FNDC5). Iryzyna, składająca się ze 112 reszt aminokwasowych, ma masę cząsteczkową około 12 kD. Jia i in [7] odkryli, że ćwiczenia na bieżni o umiarkowanej intensywności podwyższają poziom iryzyny, wywierając korzystny wpływ terapeutyczny na chorobę zwyrodnieniową stawów. Efekty te można złagodzić, stosując przeciwciała neutralizujące iryzynę. Co więcej, iryzyna przywróciła ekspresję kolagenu II i zmniejszyła poziomy MMP-13 i ADAMTS-5 w chondrocytach OA indukowanych IL-1β poprzez tłumienie szlaku sygnałowego PI3K/Akt/NF-κB i zmniejszoną piroptozę w chondrocytach poprzez hamowanie aktywności NLRP3/kaspazy-1 . Z badań wynika, że umiarkowana stymulacja mechaniczna może chronić przed piroptozą chondrocytów poprzez hamowanie szlaku PI3K/Akt/NF-κB za pośrednictwem iryzyny w chorobie zwyrodnieniowej stawów. Kolejną miokiną jest Interleukina – 6 – uwalniania do krwioobiegu podczas wykonywania aktywności fizycznej. odkryli, że ćwiczenia na bieżni o umiarkowanej intensywności podwyższają poziom iryzyny, wywierając korzystny wpływ terapeutyczny na chorobę zwyrodnieniową stawów. Efekty te można złagodzić, stosując przeciwciała neutralizujące iryzynę. Co więcej, iryzyna przywróciła ekspresję kolagenu II i zmniejszyła poziomy MMP-13 i ADAMTS-5 w chondrocytach OA indukowanych IL-1β poprzez tłumienie szlaku sygnałowego PI3K/Akt/NF-κB i zmniejszoną piroptozę w chondrocytach poprzez hamowanie aktywności NLRP3/kaspazy-1 . Z badań wynika, że umiarkowana stymulacja mechaniczna może chronić przed piroptozą chondrocytów poprzez hamowanie szlaku PI3K/Akt/NF-κB za pośrednictwem iryzyny w chorobie zwyrodnieniowej stawów. Yang i in. podali, że hipometylacja DNA i hiperacetylację histonów obserwowano w regionach promotora IL-6 w płynie stawowym związanym z chorobą zwyrodnieniową stawów. Suzuki i in. podali, że IL-6 indukuje komórki błony maziowej do wytwarzania MMP-1, MMP-3 i MMP-13. Inni badacze odkryli, że w stawach z chorobą zwyrodnieniową stawów zwiększa się odkładanie kryształów zasadowego fosforanu wapnia (BCP), stymulując syntezę IL-6 przez chondrocyty stawowe. IL-6 stymuluje wytwarzanie IL-6 w sposób autokrynny i odkładanie się kryształów poprzez indukcję genów zwapnienia Ank, Anx5 i Pit1. Spowoduje to utrzymanie produkcji IL-6 indukowanej kryształami BCP. To błędne koło indukuje enzymy degradujące macierz chrząstki (takie jak Mmp-3 i Mmp-13 oraz Adamts-4 i Adamts-5) [1]. Jednak niektóre badania wykazały również, że poziom IL-6 był podwyższony w stawach z objawowymi ubytkami chrząstki lub chorobą zwyrodnieniową stawów w porównaniu ze zdrowymi stawami, co powoduje brak klarowności co do powiązania tej miokiny z osteoartrozą. Następnym związkiem jest Interleukina 7 – chociaż powiązano ją z chorobą zwyrodnieniową stawów, rola IL-7 w tym kontekście jest głównie szkodliwa, przyczyniając się do niszczenia chrząstki w różnych schorzeniach stawów, w tym w właśnie chorobie zwyrodnieniowej stawów [8]. Co więcej, analiza przeprowadzona na małpach wykazała zwiększone wydzielanie IL-7 w próbkach łąkotki w podeszłym wieku ze zmianami zwyrodnieniowymi stawów w porównaniu ze zdrowymi odpowiednikami, co oznacza, że IL-7 jest raczej markerem niż środkiem terapeutycznym w leczeniu osteoartrozy [1]. Opisać warto jeszcze jeden związek – miostatyna, czyli czynnik różnicowania wzrostu 8 (GDF8), wzrasta wraz z wysiłkiem fizycznym. Wykazuje wyższe stężenie w surowicy u pacjentów z chorobą zwyrodnieniową stawów, co koreluje z ciężkością choroby [9]. Cytokiny prozapalne, takie jak TNF-α, IL-1 i IL-17, zwiększają ekspresję miostatyny w ludzkich synowiocytach. Ponadto przewlekła ekspozycja na cytokiny zapalne prowadzi do zwiększonej ekspresji miostatyny w błonie maziowej myszy hTNFtg. Obserwacje te sugerują obiecującą ścieżkę leczenia choroby zwyrodnieniowej stawów, w której ukierunkowanie na miostatynę mogłoby potencjalnie zmniejszyć stan zapalny i zniszczenie stawów, torując drogę nowemu farmakologicznemu podejściu do leczenia choroby zwyrodnieniowej stawów. Warto także wspomnieć o mleczanie, którego wytwarzanie zwiększa się u osób chorujących i który pobudza syntezę chondrocytów.
 Smart intra od Testosterone.pl – suplement, który znajdzie swe zastosowanie w celu optymalizacji pracy układu nerwowego, zmniejszenia i opóźnienia wystąpienia uczucia zmęczenia – KUP TUTAJ
Smart intra od Testosterone.pl – suplement, który znajdzie swe zastosowanie w celu optymalizacji pracy układu nerwowego, zmniejszenia i opóźnienia wystąpienia uczucia zmęczenia – KUP TUTAJ
Kardiokiny
Sekretomy wytwarzane przez serce podczas ćwiczeń obejmują grupę białek określanych jako kardiokiny. Niedawne odkrycia potwierdzają koncepcję serca jako narządu wydzielniczego wytwarzającego różnorodne czynniki sercowe, które mogą wpływać na funkcjonowanie różnych typów komórek. Czynniki sercowe mogą także brać udział w procesach wirusowych, oddziałując na dystalne tkanki metaboliczne i wpływając na homeostazę ogólnoustrojową. Czynniki sercowe mają działanie ochronne i szkodliwe w chorobie zwyrodnieniowej stawów. W procesie patologicznym brak równowagi wywołany czynnikami sercowymi może prowadzić do choroby [1]. Część nadrodziny transformującego czynnika wzrostu β, GDF-15 lub cytokina 1 hamująca makrofagi została podkreślona w ostatnich badaniach ze względu na jej zwiększony poziom w krążeniu po wysiłku fizycznym, zarówno u myszy, jak i ludzi. Niedawne badanie wskazało, że GDF-15 jest głównym czynnikiem powodującym starzenie się komórek w chondrocytach dotkniętych chorobą zwyrodnieniową stawów poprzez aktywację MAPK14, co sugeruje jego zasadniczą rolę w postępie choroby zwyrodnieniowej stawów [1]. Wykazując funkcje immunomodulacyjne w chorobie zwyrodnieniowej kolejna kardiokina, czyli aktywina A reguluje obniża syntezę kolagenu typu II w chrząstce stawowej w okresie dojrzałości kostnej i jej reaktywację podczas prób naprawy choroby zwyrodnieniowej stawów, co sugeruje jej rolę jako potencjalnego czynnika anabolicznego w chrząstce [10]. Idąc dalej Źródłem Folistantyny (FLSTL1) są komórki mięśni gładkich, komórki śródbłonka i kardiomiocyty. Ćwiczenia mogą podnieść poziom krążącego FSTL1 i poprawić transkrypcję FSTL1 w mięśniach szkieletowych. Dzięki silnej obecności na skrzyżowaniu pogarszającej się kości i zapalnej łuski maziowej, FSTL1 jest pozycjonowany jako możliwy biomarker choroby zwyrodnieniowej stawów i może odzwierciedlać stopień zniszczenia stawów. Według badań FSTL1 może być stosowany jako biomarker w surowicy wskazujący stopień uszkodzenia stawów u pacjentów z chorobą zwyrodnieniową stawów. W szczególności odgrywa kluczową rolę w patofizjologii choroby zwyrodnieniowej stawów, promując proliferację synowiocytów poprzez aktywację szlaku NF-κB. Późniejsze badania Chaly i wsp. ujawniły funkcję regulacyjną FSTL1 w aktywności chondrocytów, a także jego powiązanie ze szlakiem SAPK/JNK/Kaspaza3, który promuje apoptozę. Łącznie nasze odkrycia potwierdzają zastosowanie celowania FSTL1 w planach leczenia choroby zwyrodnieniowej stawów [1,11]. Kolejną kardiokiną jest czynnik hamujący migrację (MIF). Jest to cytokina makrofagów, która moduluje odpowiedź zapalną i immunologiczną [12]. Wytwarzany przez kardiomiocyty w sercu, jego wydzielanie nasila się podczas ćwiczeń, dzięki czemu związek ten został zaklasyfikowany jako kardiokina. Obserwacje wskazują na podwyższony poziom czynnika hamującego migrację w surowicy i płynie maziowym u pacjentów z chorobą zwyrodnieniową stawu kolanowego, co wskazuje na silną korelację z ciężkością choroby [13]. W związku z tym MIF jawi się jako potencjalny nowy biomarker do oceny ryzyka i nasilenia choroby zwyrodnieniowej stawu kolanowego. Co ciekawe, delecja czynnika hamującego migrację może łagodzić nasilenie choroby zwyrodnieniowej stawów, przy czym poziomy MIF w płynie stawowym są niezależnie powiązane z nasileniem zgłaszanego przez pacjentów bólu. Na koniec tego podrozdziału warto jeszcze wspomnieć o neuregulinie. Ćwiczenia stymulują ekspresję neureguliny w ludzkich komórkach śródbłonka serca, a jednym z ważnych członków rodziny ligandów zewnątrzkomórkowych podobnych do EGF jest neuregulina-4 (NRG4). NRG4 zapobiega chorobie zwyrodnieniowej stawów, zmniejszając stan zapalny, chroniąc chondrocyty przed apoptozą i zmniejszając degradację ECM poprzez kaskadę sygnalizacyjną MAPK/JNK. Jest aktywowany przez receptorowe kinazy tyrozynowe ErbB4 na cytomembranie [14].
 Omega 3 od Testosterone.pl – źródło niezbędnych kwasów tłuszczowych – KUP TUTAJ
Omega 3 od Testosterone.pl – źródło niezbędnych kwasów tłuszczowych – KUP TUTAJ
Adipokiny
Adipokiny to związki, które wytwarzana są przez tkankę tłuszczową, w ich skład wchodzą bioaktywne peptydy lub białka, cząsteczki odpornościowe i mediatory stanu zapalnego, w tym adiponektynę i leptynę. Ich zwiększona synteza poprzez ćwiczenia czyni je centralnymi punktami terapii ruchowej choroby zwyrodnieniowej stawów. Wracając do adiponektyny, chyba najbardziej rozpoznawalnej exerkiny pochodzenia tłuszczowego, jest ona wydzielana głównie przez adipocyty oraz zauważono jej podwyższony poziom podczas ćwiczeń, co może sugerować patofizjologię choroby zwyrodnieniowej stawów [1]. Co ciekawe zauważa się spadek stężenia adiponektyny wraz z zaostrzeniem choroby zwyrodnieniowej stawów, natomiast jego ekspresja pozostaje wyższa u pacjentów z chorobą zwyrodnieniową stawów w porównaniu do osób zdrowych [15]. Badania pokazują, że adiponektyna chroni przed chorobą zwyrodnieniową stawów poprzez zwiększenie proliferacji chondrocytów i poziomu kolagenu i agrekanu w chondrocytach typu II. Kolejnym związkiem jest Wisfatyna – enzym krytyczny w podstawowych procesach komórkowych regulowanych przez NAD+, w tym w procesie starzenia, stresie oksydacyjnym i sygnalizacji sirtuiny. Enzym ten ulega znacznemu zwiększeniu po krótkotrwałych umiarkowanych ćwiczeniach aerobowych, co klasyfikuje go jako adipokinę indukowaną wysiłkiem fizycznym. Wisfatyna odgrywa znaczącą rolę w patofizjologii choroby zwyrodnieniowej stawów, gdzie w trakcie postępu choroby wykazuje miejscowe działanie na stawy. Ponadto wisfatyna zwiększa ekspresję międzykomórkowej cząsteczki adhezyjnej typu 1 (ICAM-1) w ludzkich fibroblastach maziowych choroby zwyrodnieniowej stawów (OASF), promując przyleganie monocytów do fibroblastów maziowych i sprzyjając angiogenezie poprzez zwiększoną ekspresję czynnika wzrostu śródbłonka naczyń (VEGF). Powiązano go także z indukcją apoptozy i stresu oksydacyjnego w ludzkich chondrocytach choroby zwyrodnieniowej stawów. Ostatnią opisywaną adipokiną będzie Apelina. Związek ten Apelina jest peptydem o długości od 13 do 36 aminokwasów, którego funkcje biologiczne zależą od jego specyficznego receptora, APJ, receptora sprzężonego z białkiem G z siedmioma domenami transbłonowymi. Wiadomo również, że jej poziom wzrasta w odpowiedzi na wysiłek fizyczny, co klasyfikuje ją również jako exerkinę. Badania wykazały, że zmniejszenie ekspresji apeliny może zmniejszyć nasilenie choroby zwyrodnieniowej chrząstki, co sugeruje możliwą opcję leczenia. Apelina zwiększa także ekspresję IL-1β w fibroblaście maziowym poprzez stymulację szlaków PI3K i ERK, co podkreśla jej wkład w rozwój i/lub progresję choroby zwyrodnieniowej stawów. Wyniki te rzucają światło na znaczenie apeliny w zrozumieniu złożonej patofizjologii choroby zwyrodnieniowej stawów i przedstawiają świeże spojrzenie na badanie tej choroby [1].
Białko WPC80 – idealne uzupełnienie diety każdego sportowca – KUP TUTAJ
Wnioski
Ćwiczenia fizyczne są kluczowym czynnikiem zapewniającym korzyści zdrowotne, promującym niezbędną koordynację i komunikację między różnymi narządami i układami. Chociaż powszechnie wiadomo, że ćwiczenia pomagają zmniejszyć objawy choroby zwyrodnieniowej stawów, niewiele wiadomo na temat mechanizmów leżących u jej podstaw i dokładnej skali tych skutków. Dzięki zastosowaniu wiedzy zdobytej w badaniach nad exerkinami paradygmat „ćwiczenia to medycyna” może wiele zyskać, tworząc nowe możliwości dla dyskursu na temat zdrowia publicznego. Choroba zwyrodnieniowa stawów jest heterogenną i skomplikowaną chorobą charakteryzującą się uszkodzeniem chrząstki stawowej, zapaleniem błony maziowej, przebudową kości podchrzęstnej i tworzeniem się osteofitów, czyli swego rodzaju nabudowań w obrębie kości. Czynniki podatności obejmują czynniki ogólnoustrojowe (genetyka, starzenie się, płeć, rasa, praca fizyczna, otyłość i nadciśnienie) i czynniki lokalne (nieprawidłowe linie wytrzymałości stawów, słaba siła mięśni, ćwiczenia o dużej intensywności (przeciążenie) i historia urazów stawów). Procesy patofizjologiczne choroby zwyrodnieniowej stawów obejmują wiele tkanek i narządów, a badanie komunikacji między tkankami ma kluczowe znaczenie w leczeniu wysiłkowym choroby zwyrodnieniowej stawów. W ostatnich latach mięśnie szkieletowe, serce i tkanka tłuszczowa są uważane za narządy wydzielnicze spełniające funkcje endokrynologiczne, które mogą wytwarzać i wydzielać cząsteczki związane z wysiłkiem fizycznym, które biorą udział w terapii ruchowej choroby zwyrodnieniowej stawów. Wiele z istniejących badań w tej dziedzinie koncentruje się na mięśniach szkieletowych jako głównym źródle exerkin. Jednak współczesne wysiłki rozszerzają tę uwagę, aby objąć inne potencjalne źródła, w tym serce i tkankę tłuszczową, aby pogłębić naszą wiedzę na temat tego, w jaki sposób ćwiczenia pomagają w przywróceniu i utrzymaniu zdrowia. Zasadniczo różne ataki ćwiczeń modulują uwalnianie różnych substancji, a mianowicie miokin, kardiokin i adipokin, na których skupiono się w tym artykule. Należy jednak pamiętać i zdawać sobie sprawę, że chociaż korzyści zdrowotne wynikające ze stosowania exerkin są dobrze znane, oczywiste jest również, że nie wszystkie czynniki pozytywnie wpływają na choroby zwyrodnieniowe stawów podczas ćwiczeń. Pomimo tego, że poziom ten ulega zwiększeniu poprzez ćwiczenia, niektóre czynniki mogą mieć niekorzystne skutki, na co prawdopodobnie ma wpływ intensywność i częstotliwość ćwiczeń oraz pochodzenie exerkin. Ta rozbieżność wynika z wieloaspektowego wpływu ćwiczeń na chorobę zwyrodnieniową stawu kolanowego, obejmującego między innymi takie elementy, jak stymulacja mechaniczna i uwalnianie exerkin.
[1] Jia S, Yu Z, Bai L. Exerkines and osteoarthritis. Front Physiol. 2023 Dec 1;14:1302769.
[2] Latourte, A., Kloppenburg, M., and Richette, P. (2020). Emerging pharmaceutical therapies for osteoarthritis. Nat. Rev. Rheumatol. 16 (12), 673–688.
[3] Holden, M. A., Nicolson, P. J. A., Thomas, M. J., Corp, N., Hinman, R. S., and Bennell, K. L. (2023). Osteoarthritis year in review 2022: rehabilitation. Osteoarthr. Cartil. 31 (2), 177–186.
[4] Bennell, K. L., Lawford, B. J., Keating, C., Brown, C., Kasza, J., Mackenzie, D., et al. (2022). Comparing video-based, telehealth-delivered exercise and weight loss programs with online education on outcomes of knee osteoarthritis: a randomized trial. Ann. Intern Med. 175 (2), 198–209.
[5] Luo, J., Liu, W., Feng, F., and Chen, L. (2021). Apelin/APJ system: a novel therapeutic target for locomotor system diseases. Eur. J. Pharmacol. 906, 174286.
[6] Bostrom, P., Wu, J., Jedrychowski, M. P., Korde, A., Ye, L., Lo, J. C., et al. (2012). A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature 481 (7382), 463–468.
[7] Jia, S., Yang, Y., Bai, Y., Wei, Y., Zhang, H., Tian, Y., et al. (2022). Mechanical stimulation protects against chondrocyte pyroptosis through irisin-induced suppression of PI3K/Akt/NF-κB signal pathway in osteoarthritis. Front. Cell Dev. Biol. 10, 797855.
[8] Long, D., Blake, S., Song, X. Y., Lark, M., and Loeser, R. F. (2008). Human articular chondrocytes produce IL-7 and respond to IL-7 with increased production of matrix metalloproteinase-13. Arthritis Res. Ther. 10 (1), R23. doi:10.1186/ar2376
[9] Kim, J. S., Galvão, D. A., Newton, R. U., Gray, E., and Taaffe, D. R. (2021). Exercise- induced myokines and their effect on prostate cancer. Nat. Rev. Urol. 18 (9), 519–542.
[10] Hermansson, M., Sawaji, Y., Bolton, M., Alexander, S., Wallace, A., Begum, S., et al. (2004). Proteomic analysis of articular cartilage shows increased type II collagen synthesis in osteoarthritis and expression of inhibin betaA (activin A), a regulatory molecule for chondrocytes. J. Biol. Chem. 279 (42), 43514–43521.
[11] Chaly, Y., Blair, H. C., Smith, S. M., Bushnell, D. S., Marinov, A. D., Campfield, B. T., et al. (2015). Follistatin-like protein 1 regulates chondrocyte proliferation and chondrogenic differentiation of mesenchymal stem cells. Ann. Rheum. Dis. 74 (7), 1467–1473.
[12] Calandra, T., and Roger, T. (2003). Macrophage migration inhibitory factor: a regulator ofinnate immunity. Nat. Rev. Immunol. 3 (10), 791–800.
[13] Liu, M., and Hu, C. (2012). Association of MIF in serum and synovial fluid with severity of knee osteoarthritis. Clin. Biochem. 45 (10-11), 737–739.
[14] Cai, M. X., Shi, X. C., Chen, T., Tan, Z. N., Lin, Q. Q., Du, S. J., et al. (2016). Exercise training activates neuregulin 1/ErbB signaling and promotes cardiac repair in a rat myocardial infarction model. Life Sci. 149, 1–9. doi:10.1016/j.lfs.2016.02.055
[15] Honsawek, S., and Chayanupatkul, M. (2010). Correlation of plasma and synovial fluid adiponectin with knee osteoarthritis severity. Arch. Med. Res. 41 (8), 593–598