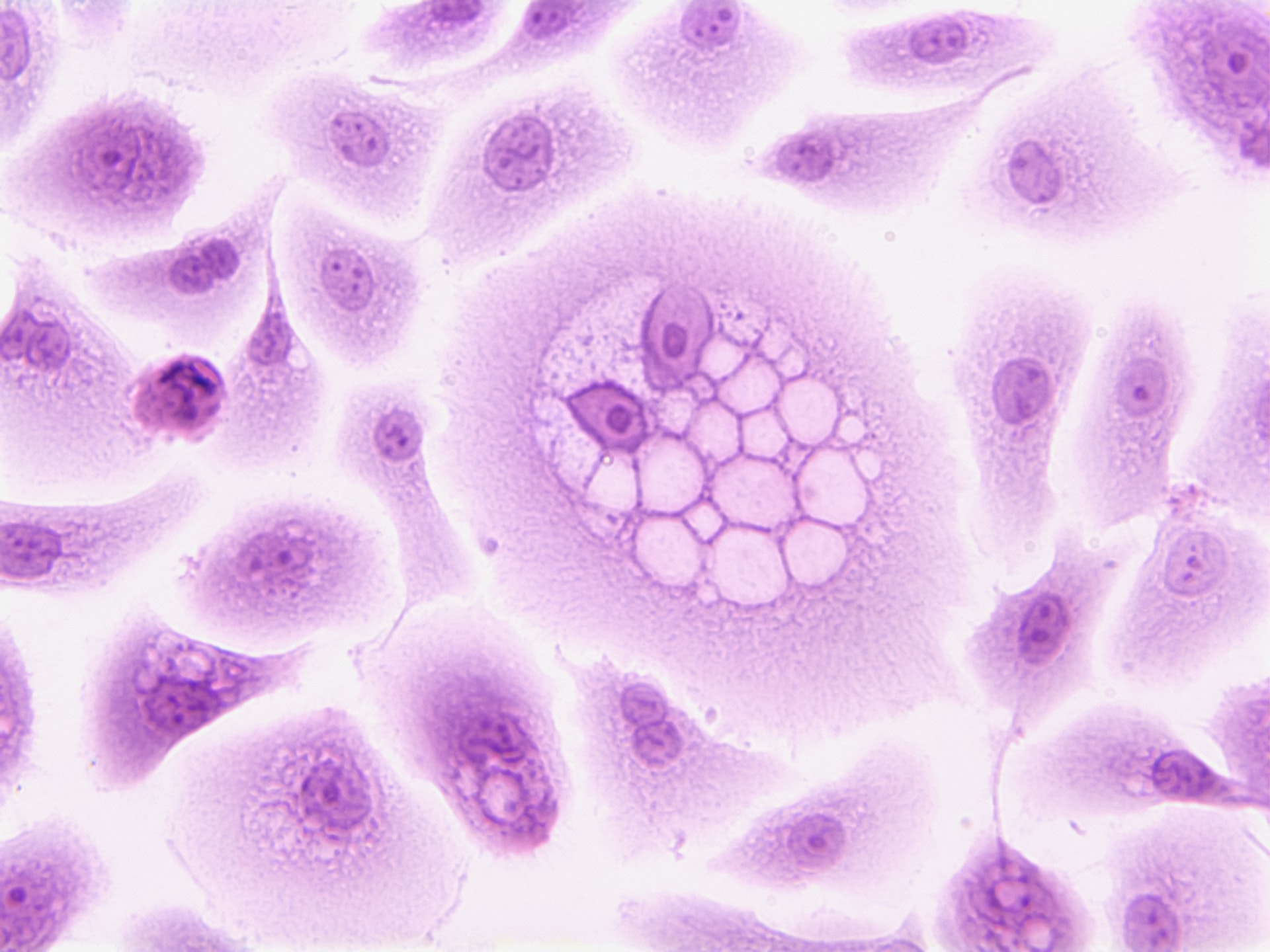
Komórki macierzyste to surowce dla organizmu. W odpowiednich warunkach w organizmie lub w laboratorium komórki macierzyste dzielą się, tworząc więcej komórek zwanych komórkami potomnymi. Te komórki potomne stają się albo nowymi komórkami macierzystymi, albo wyspecjalizowanymi komórkami o bardziej specyficznej funkcji, takimi jak komórki krwi, komórki mózgu, komórki mięśnia sercowego lub komórki kości. Żadna inna komórka w ciele nie ma naturalnej zdolności do generowania nowych typów komórek.
Rodzaje komórek macierzystych
Embrionalne komórki macierzyste – pluripotencjalne
Embrionalne komórki macierzyste (ESC) uzyskuje się z wewnętrznej masy komórkowej blastocytów, głównej pustej kuli komórek, która u człowieka tworzy się od trzech do pięciu dni po zapłodnieniu komórki jajowej przez plemnik. Ludzka blastocysta ma rozmiar mniej więcej kropki nad tym „i”.
W normalnym rozwoju komórki wewnętrznej masy komórkowej dadzą początek bardziej wyspecjalizowanym komórkom, które dają start całemu ciału – wszystkim naszym tkankom i narządom. Kiedy jednak naukowcy wyodrębniają wewnętrzną masę komórkową i hodują te komórki w specjalnych warunkach laboratoryjnych, zachowują one właściwości embrionalnych komórek macierzystych.
Embrionalne komórki macierzyste są pluripotencjalne, co oznacza, że mogą dać początek każdemu typowi komórek w pełni uformowanym ciele, z wyjątkiem łożyska i pępowiny. Komórki te są niezwykle cenne, ponieważ stanowią odnawialne źródło do badania normalnego rozwoju i chorób oraz do testowania leków i innych terapii. Ludzkie embrionalne komórki macierzyste pochodzą głównie z blastocyst powstałych w wyniku zapłodnienia in vitro do wspomaganego rozrodu, które nie były już potrzebne.
Specyficzne-tkankowo komórki macierzyste – multipotencjalne
Dane komórki (nazywane również somatycznymi lub dorosłymi komórkami macierzystymi) są bardziej wyspecjalizowane niż embrionalne komórki macierzyste. Zazwyczaj te komórki mogą generować różne typy komórek dla określonej tkanki lub narządu, w którym żyją. Na przykład krwiotwórcze (lub hematopoetyczne) komórki macierzyste w szpiku kostnym mogą prowadzić do powstania czerwonych krwinek, białych krwinek i płytek krwi. Jednak krwiotwórcze komórki macierzyste nie wytwarzają komórek wątroby, płuc ani mózgu, a komórki macierzyste w innych tkankach i narządach nie wytwarzają czerwonych lub białych krwinek ani płytek krwi. Inaczej nazywano je multipotencjalnymi.
Niektóre tkanki i narządy w naszym ciele zawierają małe magazyny specyficznych tkankowo komórek macierzystych, których zadaniem jest zastąpienie komórek z tej tkanki utraconych w normalnym codziennym życiu lub w wyniku urazu, na przykład w skórze, krwi, i błony śluzowej jelit.
Specyficzne tkankowo komórki macierzyste mogą być trudne do znalezienia w ludzkim ciele i nie wydają się samoodnawiać w hodowli tak łatwo, jak robią to embrionalne komórki macierzyste. Jednak badanie tych komórek poszerzyło naszą ogólną wiedzę na temat prawidłowego rozwoju, zmian zachodzących w procesie starzenia oraz tego, co dzieje się z urazami i chorobami.
Wśród dorosłych komórek można także wyróżnić następujące grupy:
- Mezenchymalne komórki macierzyste (lub stromalne)
- Nerwowe komórki macierzyste
- Nabłonkowe komórki macierzyste
- Komórki macierzyste skóry
Indukowane pluripotencjalne komórki macierzyste
Indukowane pluripotencjalne komórki macierzyste (iPS) to komórki, które zostały opracowane w laboratorium poprzez przekształcenie komórek swoistych tkankowo, takich jak komórki skóry, w komórki, które zachowują się jak embrionalne komórki macierzyste. Komórki IPS są kluczowymi narzędziami, które pomagają naukowcom dowiedzieć się więcej o prawidłowym rozwoju oraz początku i postępie choroby, a także są przydatne do opracowywania i testowania nowych leków i terapii.
Najważniejszą cechą tych komórek jest ich zdolność do różnicowania się w dowolny listek zarodkowy, podobnie jak te ludzkie, co wyklucza debatę etyczną dotyczącą ich stosowania (później o niej wspomnimy). Chociaż komórki iPS mają wiele takich samych cech embrionalnych komórek macierzystych, w tym zdolność do tworzenia wszystkich typów komórek w organizmie, nie są one dokładnie takie same. Ponieważ mogą być generowane z własnych komórek pacjenta, IPS przedstawiają obiecujący potencjał do produkcji pluripotencjalnych komórek dopasowanych do pacjenta, które można by wykorzystać do autologicznego przeszczepu.
Naukowcy badają, na czym polegają te różnice i co oznaczają. Po pierwsze, pierwsze komórki iPS zostały wyprodukowane przy użyciu wirusów do wstawiania dodatkowych kopii genów do komórek specyficznych dla tkanki. Naukowcy eksperymentują z wieloma alternatywnymi sposobami tworzenia komórek iPS, aby ostatecznie można je było wykorzystać jako źródło komórek lub tkanek, do leczenia, wykrywania i usuwania niecałkowicie zróżnicowanych komórek, zajmowania się zmianami genomowymi i epigenetycznymi w wytworzonych komórkach oraz przezwyciężania rakotwórczości tych komórek, która może powstać podczas przeszczepu.
Witamina D3 od Apollo’s Hegemony – prosty sposób, aby wesprzeć zdrowie organizmu
Kluczowa data
To było w 2006 roku, kiedy Shinya Yamanka dokonał naukowego przełomu w badaniach nad komórkami macierzystymi, udało mu się wytworzyć komórki o takich samych właściwościach i profilu genetycznym jak ludzkie embrionalne komórki macierzyste. Komórki te nazwano pluripotencjalnymi komórkami macierzystymi indukowanymi przez pacjenta i od tamtej pory zmieniły dziedzinę badań nad komórkami macierzystymi. Zostały one opisane wyżej.
Aspekty stosowania terapii komórkowej
Terapia komórkowa jako modalność medycyny regeneracyjnej jest uważana za jedną z najbardziej obiecujących dziedzin współczesnej nauki i medycyny. Tak zaawansowana technologia oferuje nieskończone możliwości transformacyjnych i potencjalnie leczniczych metod leczenia niektórych z najbardziej zagrażających życiu chorób humanistycznych. Medycyna regeneracyjna szybko staje się kolejną wielką rzeczą w opiece zdrowotnej, której szczególnym celem jest naprawa i być może zastąpienie chorych komórek, tkanek lub narządów i ostatecznie przywrócenie normalnego funkcjonowania. Na szczęście perspektywa medycyny regeneracyjnej jako alternatywy dla konwencjonalnych terapii opartych na lekach staje się z dnia na dzień namacalną rzeczywistością.
Terapie oparte na komórkach macierzystych definiuje się jako każde leczenie choroby lub stanu chorobowego, które zasadniczo obejmuje wykorzystanie wszelkiego rodzaju żywotnych ludzkich komórek macierzystych, w tym embrionalnych komórek macierzystych (ESC), iPSC i dorosłych komórek macierzystych. Komórki macierzyste stanowią idealne rozwiązanie, gdy istnieje potrzeba przeszczepu tkanek i narządów, dzięki ich zdolności do różnicowania się w określone typy komórek, które są wymagane do naprawy chorych tkanek.
Uważa się, że komórki macierzyste pośredniczą w naprawie poprzez pięć głównych mechanizmów:
1) działanie przeciwzapalne
2) zasiedlanie uszkodzonych tkanek i rekrutację innych komórek, takich jak komórki progenitorowe śródbłonka, które są niezbędne do wzrostu tkanki
3) wspieranie przebudowy tkanki nad tworzeniem się blizn
4) hamowanie apoptozy (śmierci komórek)
5) różnicowanie się w tkankę kostną, chrzęstną, ścięgnistą i więzadłową.
Obecnie niektóre terapie oparte na komórkach macierzystych z wykorzystaniem dorosłych komórek macierzystych są dostępne klinicznie i obejmują głównie przeszczepy szpiku kostnego krwiotwórczych komórek macierzystych oraz przeszczepy skóry w przypadku ciężkich oparzeń. Do chwili obecnej istnieje ponad 3000 badań z wykorzystaniem dorosłych komórek macierzystych zarejestrowanych w Międzynarodowym Rejestrze Badań Klinicznych WHO. Ponadto rejestrowane są również wstępne badania obejmujące nowe i atrakcyjne terapie oparte na iPSC. W rzeczywistości pierwsza próba kliniczna wykorzystująca iPSC przyniosła pomyślne wyniki w leczeniu zwyrodnienia plamki żółtej oka. Biorąc pod uwagę względną niedojrzałość w dziedzinie terapii komórkowej, wyniki takich prób ułatwią zrozumienie ram czasowych potrzebnych do osiągnięcia skutecznych terapii i pomogą w lepszym zrozumieniu chorób.
Jak się podaje komórki macierzyste?
Nie należy pomijać drogi podania na korzyść liczby przeszczepionych komórek macierzystych. W kilku doniesieniach wykazano, że zdolność wszczepienia zazwyczaj ma mniejszą szybkość dotarcia do narządów docelowych w stosunku do liczby przeszczepionych komórek i nie ma tymczasowego dłuższego czasu trwania.
Sposoby podawania komórek macierzystych można podzielić na miejscowe i ogólne. Lokalna transmisja obejmuje określone wstrzyknięcia poprzez różne manipulacje i bezpośrednie wstrzyknięcia do narządów, takie jak wstrzyknięcia dootrzewnowe, domięśniowe i do serca. Transmisja ogólnoustrojowa wykorzystuje szlaki naczyniowe, takie jak metody dożylne i dotętnicze lub nawet dośledzionowo.
Terapia komórkowa a prawo i etyka
Wraz ze wzrostem liczby badań klinicznych wykorzystujących komórki macierzyste jako podejścia terapeutyczne, potrzeba opracowania wytycznych i standardów regulacyjnych w celu zapewnienia bezpieczeństwa pacjentów staje się coraz bardziej istotna. Jednak fakt, że terapia komórkami macierzystymi jest stosunkowo nową dziedziną, powoduje, że jest przedmiotem kontrowersji naukowych, etycznych i prawnych, które nie zostały jeszcze uregulowane. Wiodące kraje w tej dziedzinie opracowały wytyczne służące temu celowi. Niedawno Food and Drug Administration (FDA) wydała wytyczne regulacyjne, aby zapewnić, że te metody leczenia są bezpieczne i skuteczne. Wytyczne te stwierdzają, że; terapie z wykorzystaniem komórek macierzystych, które zostały poddane minimalnej manipulacji i są przeznaczone do jednorodnego użytku, nie wymagają zatwierdzenia przed wprowadzeniem na rynek i powinny podlegać jedynie wytycznym regulacyjnym dotyczącym przenoszenia chorób. W 2014 r. w Japonii nastąpiła radykalna reforma regulacyjna wraz z uchwaleniem dwóch nowych przepisów, które zezwalały na warunkowe zatwierdzanie terapii komórkowych po badaniach klinicznych wczesnej fazy, pod warunkiem dostarczenia danych dotyczących bezpieczeństwa klinicznego od co najmniej dziesięciu pacjentów. Przepisy te pozwalają na pominięcie większości tradycyjnych kryteriów badań klinicznych w tak zwanej „szybkiej ścieżce zatwierdzania”, a terapie zostały sklasyfikowane zgodnie z ryzykiem. Do tej pory terapie, które uzyskały warunkową zgodę, obejmują te ukierunkowane; uraz rdzenia kręgowego, choroby serca i niedokrwienie kończyn.
Terapie oparte na komórkach macierzystych napotykają wiele przeszkód, którymi należy się pilnie zająć. Najbardziej uporczywym problemem jest konflikt etyczny dotyczący korzystania z ESC. Jak wcześniej wspomniano, ESC są znacznie lepsze pod względem siły działania; jednak ich pochodzenie wymaga zniszczenia embrionów ludzkich. To prawda, że odkrycie iPSC przezwyciężyło ten problem; niemniej jednak same iPSC stoją obecnie w obliczu innej własnej kontrowersji etycznej, która dotyczy ich nieograniczonej zdolności różnicowania z obawami, że komórki te mogą pewnego dnia zostać zastosowane w klonowaniu ludzi. Stosowanie iPSC w terapii jest nadal uważane za metodę leczenia wysokiego ryzyka, ponieważ przeszczep tych komórek może indukować tworzenie się guzów. Takie wyzwanie jest obecnie rozwiązywane poprzez opracowywanie zoptymalizowanych protokołów w celu zapewnienia ich bezpieczeństwa, oprócz opracowywania globalnych linii komórkowych iPSC klasy klinicznej, zanim te komórki będą dostępne do użytku klinicznego. Jeśli chodzi o mezenchymalne, komórki te zostały powszechnie uznane za bezpieczne, jednak ciągłe monitorowanie i przedłużona obserwacja powinny być przedmiotem przyszłych badań, aby uniknąć możliwości powstania guza po leczeniu.
Koenzym Q10 i PQQ w jednej kapsułce – połączenie wspierające well-being i anti-aging
Co będzie można nimi wyleczyć? – odpowiada nauka
Choroba Parkinsona
Ta choroba charakteryzuje się szybką utratą neuronów dopaminergicznych śródmózgowia. Pierwsza próba wykorzystania ludzkich komórek ESC do leczenia polegała na wytworzeniu neuronów podobnych do dopaminergicznych, później zaproponowano ludzkie iPSC jako alternatywę dla przezwyciężenia kontrowersji dotyczących ESC. Obie komórki dawały nadzieję na uzyskanie nieskończonego źródła neuronów dopaminergicznych zamiast dotychczas wykorzystywanych płodowych tkanek mózgowych. Następnie protokoły, które naśladowały rozwój neuronów dopaminergicznych, odniosły sukces w generowaniu neuronów dopaminergicznych podobnych do neuronów śródmózgowia, które były w stanie przetrwać, zintegrować się i dojrzewać funkcjonalnie w zwierzęcych modelach Parkinsona przedklinicznie.
W sierpniu 2018 r., Shinya Yamanka oraz inni naukowcy zainicjowali pierwsze zatwierdzone badanie kliniczne dotyczące leczenia choroby Parkinsona za pomocą iPSC. Zrekrutowano siedmiu pacjentów cierpiących na umiarkowanego Parkinsona. Zastosowano komórki allogeniczne dopasowane do dawcy, aby uniknąć genetycznego wpływu choroby. Strategia stojąca za badaniem obejmowała generowanie neuronów dopaminergicznych, a następnie chirurgiczne przeszczepianie mózgów pacjentów za pomocą specjalnego urządzenia. Ponadto podano leki immunosupresyjne, aby uniknąć działań niepożądanych. Dotychczasowe wstępne wyniki wykazały bezpieczeństwo zabiegu. Ten kierunek zapowiada się bardzo atrakycjnie, więc czekamy na wyniki badania. Badanie fazy 2 wykazało znacznie lepsze wyniki u pacjentów leczonych mezenchymalnymi komórkami macierzystymi w porównaniu z pacjentami otrzymującymi leczenie pozorowane. W styczniu 2021 roku FDA zatwierdziła pierwsze badanie kliniczne eksperymentalnej terapii komórkami macierzystymi w celu przywrócenia utraconych komórek mózgowych u osób z zaawansowaną chorobą Parkinsona.
Stwardnienie zanikowe boczne
Jest to choroba neurodegeneracyjna, która powoduje śmierć neuronów ruchowych, co skutkuje zaburzeniem pracy mięśni. Pierwsza próba leczenia polegała na przeszczepie MSC w modelu mysim. Wyniki tego eksperymentu były obiecujące i spowodowały zmniejszenie objawów choroby, a tym samym dostarczyły dowodu na zasadność wykorzystania tego środka. Na podstawie wyników w przygotowaniu jest kilka planowanych/trwających badań klinicznych. Badania te oceniają głównie bezpieczeństwo proponowanej koncepcji i jak dotąd nie wykazały sukcesu klinicznego. Warto zauważyć, że chociaż badania przedkliniczne wykazały, że komórki pochodzące od osób zdrowych są lepsze niż komórki od pacjentów z ALS.
Zawał mięśnia sercowego
Współcześnie występowanie i rozpowszechnienie niewydolności serca w społeczeństwach ludzkich jest poważnym i narastającym problemem, który niestety ma złe rokowania. Od dziesięcioleci komórki macierzyste, szczególnie stromalne, są stosowane w terapii regeneracyjnej układu sercowo-naczyniowego jako jeden z potencjalnych środków terapeutycznych. W jednym badaniu Davies i in. [2010] donieśli, że przeszczep komórek macierzystych krwi pępowinowej w owczym modelu niewydolności serca poprawił funkcję serca poprzez poprawę masy prawej komory, zarówno skurczowej, jak i rozkurczowej funkcji prawego serca.
Urazy rdzenia kręgowego
Innym wskazaniem do zastosowania komórek macierzystych są urazy rdzenia kręgowego. Przeszczep różnych form nerwowych komórek macierzystych doprowadza do wzrostu aksonów oprócz połączeń nerwowych, które stwarzają możliwość naprawy. Dowód odzyskania funkcji nie został jeszcze ustalony w rygorystycznych badaniach klinicznych. Ale nastawienie naukowców jest pozytywne. Niemniej jednak Japonia niedawno wydała zgodę na leczenie urazów rdzenia kręgowego komórkami macierzystymi. Ta aprobata została oparta na badaniach klinicznych, które nie zostały jeszcze opublikowane i obejmuje 13 pacjentów, którzy cierpią z powodu niedawnego urazu rdzenia kręgowego. Japoński zespół odkrył, że wstrzyknięcie komórek macierzystych wyizolowanych ze szpiku kostnego pacjentów pomogło w odzyskaniu części utraconego czucia i mobilności. Jest to pierwsza terapia oparta na komórkach macierzystych ukierunkowana na urazy rdzenia kręgowego, która uzyskała zgodę rządu na oferowanie pacjentom.
Rany przewlekle
Rana przewlekła jest jednym z najczęstszych problemów i powoduje znaczny niepokój pacjentów. Wśród rodzajów tkanek, z których pochodzą komórki macierzyste, MSC pochodzące z tkanek dentystycznych stanowią dobre źródło cytokin i czynników wzrostu, które wspomagają gojenie się ran. Wyniki wcześniejszych badań wykazały, że komórki macierzyste zębów mlecznych konia mogą być nowym podejściem do pielęgnacji ran i mogą być stosowane w klinicznym leczeniu niegojących się ran. W innym badaniu Lin i in. pracowali na mysim modelu zwierzęcym i wykazali, że dorosłe komórki macierzyste stanowią potencjalnie żywotną matrycę do gojenia się po głębokich urazach.
Omega-3 od Apollo’s Hegemony – skoncentrowane źródło najwyższych dawek EPA i DHA
Choroby oczu
Ogromna liczba obecnie zarejestrowanych badań klinicznych dotyczących terapii opartych na komórkach macierzystych dotyczy chorób oczu. Wynika to głównie z faktu, że oko jest miejscem uprzywilejowanym pod względem odporności. Większość z tych prób obejmuje różne kraje, w tym Japonię, Chiny, Izrael, Koreę, Wielką Brytanię i USA. Warto zauważyć, że pierwsza próba kliniczna mająca na celu wdrożenie autologicznych komórek siatkówki pochodzących z iPSC odbyła się w Japonii, zgodnie z nowymi przepisami wydanymi przez rząd Japonii w 2014 r. w celu uregulowania zastosowań medycyny regeneracyjnej. Do tego badania zrekrutowano dwóch pacjentów, pierwszy otrzymał leczenie zwyrodnienia plamki żółtej przy użyciu arkusza komórek siatkówki generowanych przez iPSC. Po 1 roku obserwacji nie stwierdzono żadnych poważnych powikłań, w tym nieprawidłowej proliferacji i ogólnoustrojowej złośliwości. Ponadto w drugiej rocznej obserwacji nie stwierdzono cech odrzucania przeszczepionej warstwy nabłonka siatkówki. Co najważniejsze, zgłaszano oznaki skorygowanej ostrości wzroku leczonego oka. Wyniki te wystarczyły, aby stwierdzić, że autologiczny przeszczep oparty na iPSC był bezpieczny i wykonalny. Warto wspomnieć, że drugi pacjent został wycofany z badania z powodu wykrywalnych zmienności genetycznych linii iPSC pacjenta, które nie były pierwotnie obecne w pierwotnych fibroblastach pacjenta. Takie zmiany mogą zagrozić ogólnemu bezpieczeństwu leczenia.
Czy wszystko takie piękne?
Aby embrionalne komórki macierzyste były użyteczne, badacze muszą mieć pewność, że komórki macierzyste będą różnicować się w pożądane typy komórek – lekarze jeszcze nie są w stanie gwarantować, że do tego dojdzie w 100%. Embrionalne komórki macierzyste mogą również wywołać odpowiedź immunologiczną, w której organizm biorcy atakuje komórki macierzyste jako obce lub komórki macierzyste mogą po prostu nie działać zgodnie z oczekiwaniami, z nieznanymi konsekwencjami. Naukowcy nadal badają, jak uniknąć tych możliwych komplikacji.
W 2013 r. stwierdzono, że badania autologicznych komórek macierzystych szpiku kostnego dotyczące funkcji komór sercowych zawierają „setki” rozbieżności. Krytycy donoszą, że z 48 raportów wydawało się, że wykorzystano tylko pięć podstawowych badań i że w wielu przypadkach to były badania z nieodpowiednią metodologią. Ogólnie rzecz biorąc, zgłoszono, że o wiele więcej osób otrzymało komórki macierzyste w badaniach, niż liczba komórek macierzystych przetworzonych w szpitalnym laboratorium w tym czasie.
W 2014 r. metaanaliza dotycząca terapii komórkami macierzystymi z wykorzystaniem komórek macierzystych szpiku kostnego w chorobach serca ujawniła rozbieżności w opublikowanych raportach z badań klinicznych, przy czym badania z większą liczbą rozbieżności wykazały wzrost wielkości efektu.
Idealna opcja dal naciągaczy? Koszty terapii komórkami macierzystymi różnią się znacznie w zależności od kliniki, stanu i typu komórek, ale najczęściej wahają się od 10 000 do 20 000 USD. Ubezpieczenie nie obejmuje zastrzyków z komórek macierzystych w klinikach, więc pacjenci często korzystają ze zbiórki pieniędzy on-line. W 2018 roku Federalna Komisja Handlu Stanów Zjednoczonych wykryła ośrodki zdrowia i indywidualnego lekarza składające bezpodstawne roszczenia dotyczące terapii komórkami macierzystymi i wymusiła zwrot około 500 000 USD.
Podsumowanie
Ogromny potencjał, ogromne koszty oraz ogromne nadzieje, kwestia czy doczekamy się sprecyzowania działania.
Bibliografia
- https://www.closerlookatstemcells.org
- Biehl JK, Russell B. Introduction to stem cell therapy. J Cardiovasc Nurs. 2009 Mar-Apr;24(2):98-103; quiz 104-5
- https://en.wikipedia.org/wiki/Stem-cell_therapy
- https://www.mayoclinic.org/tests-procedures/bone-marrow-transplant/in-depth/stem-cells/art-20048117
- Aly RM. Current state of stem cell-based therapies: an overview. Stem Cell Investig. 2020 May 15;7:8.
- Mousaei Ghasroldasht, M.; Seok, J.; Park, H.-S.; Liakath Ali, F.B.; Al-Hendy, A. Stem Cell Therapy: From Idea to Clinical Practice. Int. J. Mol. Sci. 2022, 23, 2850.
- Kim, S.U. and de Vellis, J. (2009), Stem cell-based cell therapy in neurological diseases: A review. J. Neurosci. Res., 87: 2183-2200.
- Larijani B, Nasli Esfahani E, Amini P, Nikbin B, Alimoghaddam K, Amiri S, Malekzadeh R, Mojahed Yazdi N, Ghodsi M, Dowlati Y, Sahraian MA, Ghavamzadeh A. Stem Cell Therapy in Treatment of Different Diseases. Acta Med Iran. 1;50(2):79-96.
- https://www.unmc.edu/stemcells/educational-resources/types.html
- Chari S, Nguyen A, Saxe J. Stem Cells in the Clinic. Cell Stem Cell 2018;22:781-2. 10.1016/j.stem.2018.05.017
- Pérez López S, Otero Hernández J. Advances in stem cell therapy. Adv Exp Med Biol 2012;741:290-313. 10.1007/978-1-4614-2098-9_19
- De Luca M, Aiuti A, Cossu G, et al. Advances in stem cell research and therapeutic development. Nat Cell Biol 2019;21:801-11.
- Lapteva, L.; Vatsan, R.; Purohit-Sheth, T. Regenerative medicine therapies for rare diseases. Transl. Sci. Rare Dis. 2018, 3, 121–132.
- Rajabzadeh, N.; Fathi, E.; Farahzadi, R. Stem cell-based regenerative medicine. Stem Cell Investig. 2019, 6, 19