Obrazek wyróżniający: europeana-OcDGCRNfgPc-unsplash
W ciągu ostatnich dwóch dekad zaobserwowano znaczący i systematyczny wzrost liczby przypadków uszkodzenia więzadła krzyżowego przedniego (ACL) na całym świecie, co wskazuje na rosnącą skalę tego problemu wśród osób aktywnych fizycznie, sportowców oraz ogółu populacji. Wzrost ten może być związany zarówno z większym zaangażowaniem społeczeństwa w sport i aktywność fizyczną, jak i z udoskonaleniem metod diagnostycznych, które pozwalają na skuteczniejsze wykrywanie tego typu kontuzji. Szacuje się, że długoterminowe koszty ekonomiczne związane z leczeniem, rehabilitacją oraz konsekwencjami zdrowotnymi wynikającymi z uszkodzenia ACL mogą sięgać nawet 7,6 miliarda dolarów rocznie w samych Stanach Zjednoczonych. Wysokość tych kosztów wynika nie tylko z konieczności przeprowadzenia kosztownych operacji rekonstrukcyjnych i długotrwałej rehabilitacji, ale także z utraty produktywności pacjentów, którzy często muszą na dłuższy czas zrezygnować z aktywności zawodowej i sportowej. Jednym z najpoważniejszych skutków urazu ACL oraz jego rekonstrukcji jest przyspieszone pogorszenie kondycji chrząstki stawu kolanowego, co w konsekwencji może prowadzić do jego degeneracji. U ponad połowy pacjentów, którzy doświadczyli uszkodzenia więzadła krzyżowego przedniego, dochodzi do rozwoju choroby zwyrodnieniowej stawów, czyli schorzenia powodującego przewlekły ból, ograniczenie ruchomości oraz stopniowe niszczenie struktur stawu. W zaawansowanych stadiach choroby zwyrodnieniowej może być konieczne przeprowadzenie całkowitej wymiany stawu kolanowego, co wiąże się z poważnym zabiegiem chirurgicznym, długotrwałą rekonwalescencją oraz znacznym obciążeniem zarówno dla pacjenta, jak i dla systemu opieki zdrowotnej. Mimo że w wyniku urazu bezpośrednio uszkodzeniu ulega tkanka więzadłowa, to liczne badania wykazały, że jego konsekwencją jest także znaczący zanik mięśni czworogłowych uda, który często utrzymuje się nawet po przeprowadzeniu operacji rekonstrukcyjnej. Zanik ten może prowadzić do poważnych i długotrwałych deficytów w zakresie siły oraz funkcji mięśni, co negatywnie wpływa na stabilność stawu kolanowego, zdolność do wykonywania codziennych czynności, a także na ogólną sprawność ruchową pacjenta. Nawet po zakończeniu procesu rehabilitacji u wielu pacjentów obserwuje się utrzymujące się osłabienie mięśni czworogłowych, co zwiększa ryzyko ponownych urazów oraz dalszej degradacji struktur kolanowych. Utrata masy mięśniowej w obrębie mięśnia czworogłowego jest powiązana z wieloma negatywnymi skutkami zdrowotnymi, obejmującymi osłabienie siły kończyn dolnych, pogorszenie funkcjonowania stawu kolanowego, a także obniżenie ogólnej jakości życia pacjentów, którzy często muszą ograniczyć swoją aktywność fizyczną, a w niektórych przypadkach nawet zmienić styl życia. Proces hipertrofii mięśni szkieletowych, czyli wzrostu masy mięśniowej oraz zwiększenia pola przekroju poprzecznego włókien mięśniowych, jest naturalną odpowiedzią organizmu na regularną aktywność fizyczną i odpowiednio dobrany trening oporowy. Jest to mechanizm, który pozwala na poprawę siły i wytrzymałości mięśni, co ma kluczowe znaczenie w kontekście rehabilitacji po urazach [1].
WPC80 od testosterone.pl – źródło pełnowartościowego białka – KUP TUTAJ
Atrofia
Proces odwrotny do hipertrofii, czyli zanik mięśni, charakteryzuje się stopniowym zmniejszaniem masy mięśniowej oraz redukcją pola przekroju poprzecznego włókien, co prowadzi do osłabienia zdolności ruchowych i zwiększa podatność na urazy. Jednym z istotnych powikłań związanych z uszkodzeniem i rekonstrukcją ACL jest zjawisko określane jako artrogenne hamowanie mięśni (AMI). Polega ono na zaburzeniu funkcji układu nerwowego, które powoduje osłabienie zdolności do aktywacji mięśni czworogłowych w kończynie dotkniętej urazem. Osłabiona aktywacja mięśniowa, będąca skutkiem AMI, może znacząco ograniczać efektywność ćwiczeń rehabilitacyjnych, ponieważ tkanka kurczliwa nie otrzymuje odpowiedniego bodźca do odbudowy masy mięśniowej i przywracania prawidłowej funkcji mięśni. W efekcie pacjenci po operacji rekonstrukcji ACL często zmagają się z trudnościami w powrocie do pełnej sprawności, co wydłuża proces rehabilitacji i zwiększa ryzyko kolejnych urazów. Mimo licznych badań nad tym zagadnieniem, wciąż nie są w pełni poznane molekularne mechanizmy odpowiedzialne za osłabioną zdolność do hipertrofii mięśni czworogłowych po uszkodzeniu i operacji więzadła krzyżowego przedniego. Zrozumienie tych mechanizmów mogłoby przyczynić się do opracowania bardziej skutecznych strategii terapeutycznych, które pozwoliłyby na szybszą i efektywniejszą regenerację mięśni oraz zmniejszenie negatywnych konsekwencji wynikających z urazu ACL. Dotychczas przeprowadzone badania w dużej mierze skupiały się na szczegółowej analizie mechanizmów molekularnych, które odpowiadają za proces zaniku mięśni wynikający z długotrwałego braku aktywności fizycznej. Tego rodzaju osłabienie mięśni może być spowodowane różnymi czynnikami, takimi jak długotrwałe unieruchomienie kończyny po urazie, ograniczone obciążenie mięśni wynikające z konieczności oszczędzania kontuzjowanej części ciała, a także długotrwałe leżenie w łóżku, które często towarzyszy poważnym schorzeniom lub urazom wymagającym hospitalizacji. W odpowiedzi na te wyzwania w wielu przypadkach wdrażano interwencje żywieniowe, które miały na celu nie tylko zminimalizowanie stopnia utraty masy mięśniowej, lecz także przyspieszenie jej odbudowy. Szczególnie skuteczne okazywały się strategie żywieniowe stosowane w połączeniu z innymi metodami wspierającymi proces regeneracji, takimi jak rehabilitacja ruchowa czy odpowiednio dobrane programy treningowe. Pomimo licznych badań potwierdzających negatywne skutki uszkodzenia więzadła krzyżowego przedniego oraz jego rekonstrukcji, w tym istotnego osłabienia mięśnia czworogłowego uda, które znacząco wpływa na zdolności motoryczne pacjenta oraz jego ogólny stan zdrowia w dłuższej perspektywie, wciąż brakuje kompleksowych analiz dotyczących roli interwencji żywieniowych w procesie przeciwdziałania utracie masy mięśniowej oraz jej odbudowy w trakcie i po zakończeniu rehabilitacji ACL. W szczególności odpowiednio zbilansowana dieta może stanowić kluczowy element terapii we wczesnych etapach rekonwalescencji po operacji rekonstrukcyjnej więzadła krzyżowego przedniego, pomagając ograniczyć negatywne skutki długotrwałego unieruchomienia i zmniejszyć ryzyko nasilonego zaniku mięśniowego. Ponadto właściwe nawyki żywieniowe mogą wspierać efektywną regenerację i przyrost masy mięśniowej w trakcie kolejnych faz rehabilitacji, szczególnie w połączeniu z odpowiednimi ćwiczeniami fizjoterapeutycznymi ukierunkowanymi na odbudowę siły i funkcji kończyny dolnej. Dogłębne poznanie mechanizmów, za pomocą których interwencje żywieniowe mogą wpływać na regenerację masy oraz siły mięśniowej po przebytym urazie i operacji więzadła krzyżowego przedniego, może odegrać kluczową rolę w zmniejszeniu długoterminowych konsekwencji zdrowotnych związanych z tym schorzeniem. Lepsze zrozumienie tych procesów pozwoli na opracowanie bardziej skutecznych strategii terapeutycznych, które nie tylko przyspieszą powrót pacjentów do pełnej sprawności, lecz także ograniczą ryzyko późniejszych powikłań, takich jak osłabienie mięśniowe, dysfunkcja stawu kolanowego czy zwiększone prawdopodobieństwo wystąpienia choroby zwyrodnieniowej stawów. Aby skutecznie zrealizować ten cel, konieczne jest szczegółowe przeanalizowanie zależności pomiędzy mechanizmami prowadzącymi do zaniku mięśnia czworogłowego a wpływem odpowiedniego żywienia na proces jego regeneracji, co umożliwi wdrożenie skutecznych metod wspierających pacjentów w powrocie do pełnej sprawności fizycznej [2-8].
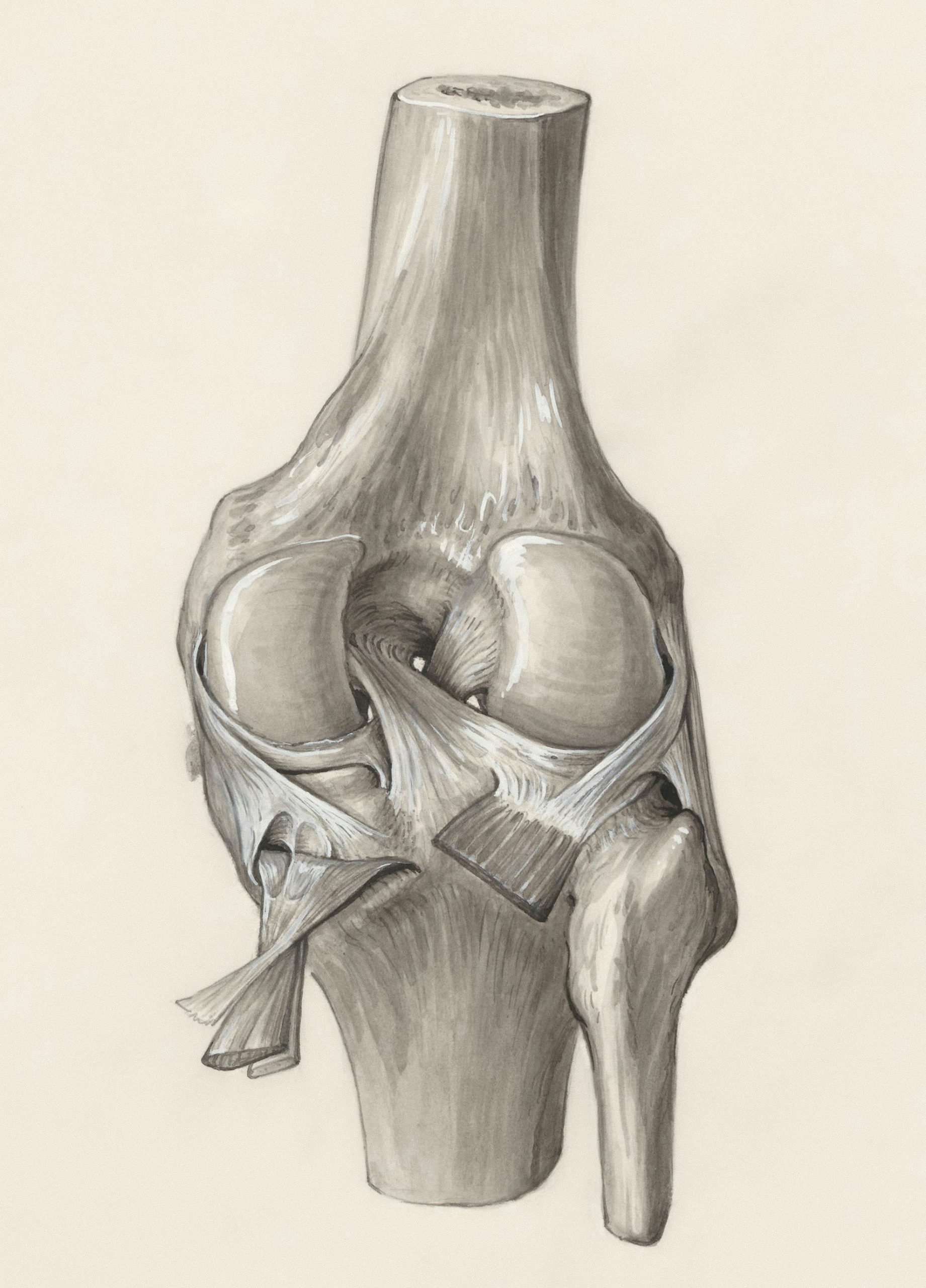
Uraz ACL i rekonstrukcja
Więzadło krzyżowe przednie pełni kluczową rolę w stabilizacji stawu kolanowego. Jego uszkodzenie może prowadzić do niestabilności stawu, co z kolei zwiększa ryzyko dodatkowych urazów, takich jak uszkodzenie chrząstki, a w dłuższej perspektywie może przyczyniać się do rozwoju choroby zwyrodnieniowej stawów. Ponadto, nawet po przejściu rehabilitacji i operacyjnej rekonstrukcji ACL, pacjenci często zgłaszają ograniczoną funkcjonalność kolana oraz podwyższone ryzyko ponownego urazu. Jednym z głównych czynników odpowiedzialnych za te trudności jest utrzymujące się osłabienie mięśnia czworogłowego, co wpływa na zdolność pacjenta do odzyskania pełnej sprawności. Z tego względu istotnym celem terapii w przypadku uszkodzenia więzadła krzyżowego przedniego jest skuteczna odbudowa funkcji i siły mięśni czworogłowych. Leczenie urazów ACL może przyjmować zarówno formę operacyjną, jak i nieoperacyjną, a wybór metody zależy od wielu czynników, takich jak wiek pacjenta, poziom aktywności fizycznej oraz stopień niestabilności stawu kolanowego. W przypadku podejścia chirurgicznego najczęściej stosuje się rekonstrukcję więzadła, w której uszkodzony fragment zostaje zastąpiony przeszczepem pobranym z innych struktur mięśniowych, takich jak ścięgno mięśnia dwugłowego uda, ścięgno rzepki lub ścięgno mięśnia czworogłowego. Niezależnie od wybranej metody leczenia, niezwykle istotnym elementem procesu powrotu do sprawności jest kompleksowy program rehabilitacyjny. W pierwszych etapach terapii celem jest zmniejszenie bólu i obrzęku, przywrócenie zakresu ruchu, aktywacja mięśni czworogłowych oraz poprawa propriocepcji. Standardowe programy rehabilitacyjne po rekonstrukcji ACL składają się zazwyczaj z czterech etapów, a ich przebieg jest uzależniony od osiągnięcia określonych kamieni milowych. Jednym z kluczowych celów końcowej fazy terapii, przypadającej zwykle na okres około dziewięciu miesięcy po operacji, jest umożliwienie pacjentowi powrotu do pełnej aktywności fizycznej, w tym uprawiania sportu. Mimo przeprowadzonej rehabilitacji, wielu pacjentów nadal doświadcza deficytów w zakresie siły oraz funkcji mięśnia czworogłowego. Przyczyną tego zjawiska jest złożona interakcja różnych mechanizmów. Ból odgrywa istotną rolę, ponieważ może bezpośrednio wpływać na hamowanie aktywacji mięśni poprzez szlaki nocyceptywne. Dodatkowo, obrzęk może zwiększać ciśnienie wewnątrzstawowe, prowadząc do zaburzenia funkcji receptorów odpowiedzialnych za prawidłowe działanie kolana. Już sam uraz prowadzi do osłabienia i zaniku mięśni, jednak operacja rekonstrukcyjna może dodatkowo potęgować te procesy poprzez uruchomienie kaskady reakcji zapalnych i metabolicznych, które sprzyjają katabolizmowi. W niektórych przypadkach proces ten może utrzymywać się nawet przez kilka tygodni po zabiegu. Istnieją również inne czynniki, które mogą pogłębiać ten problem, takie jak okresowe głodzenie pacjenta przed operacją, a także możliwe zaburzenia funkcji mięśni wynikające z uszkodzenia mechanoreceptorów lub obniżenia pobudliwości neuronów ruchowych. Te mechanizmy, choć mają na celu ochronę stawu przed dalszymi uszkodzeniami, niezamierzenie przyczyniają się do osłabienia aktywacji mięśni oraz spadku ich zdolności motorycznych. Wszystkie wymienione czynniki utrudniają skuteczną odbudowę siły i funkcji mięśni czworogłowych po rekonstrukcji ACL. Biorąc pod uwagę związek pomiędzy osłabioną siłą mięśni a niekorzystnymi wynikami terapii, takimi jak zwiększone ryzyko ponownego urazu czy przyspieszony rozwój choroby zwyrodnieniowej stawów, niezwykle istotne jest znalezienie skutecznych metod wspierających regenerację mięśni. W związku z tym konieczne jest dalsze badanie alternatywnych interwencji, które mogą przyczynić się do poprawy procesu odbudowy mięśni czworogłowych i optymalizacji wyników leczenia pacjentów po uszkodzeniu więzadła krzyżowego przedniego [9-13].
 Kofeina + Teanina od Apollo’s Hegemony zwiększa zdolności wysiłkowe podczas treningu – KUP TUTAJ
Kofeina + Teanina od Apollo’s Hegemony zwiększa zdolności wysiłkowe podczas treningu – KUP TUTAJ
Dlaczego mięsień zanika
Proces zaniku mięśni następuje bardzo szybko w sytuacjach unieruchomienia, braku obciążenia lub długotrwałego leżenia. Utrata masy mięśniowej może wynosić nawet 0,5% dziennie, co w pierwszych dwóch tygodniach nieaktywności skutkuje redukcją od 150 do 400 gramów tkanki mięśniowej w jednej nodze. Taki gwałtowny zanik jest związany z obniżeniem syntezy białek zarówno po okresie wchłonięcia, jak i po spożyciu posiłku. Wzrost i regeneracja mięśni są regulowane przez różne szlaki sygnałowe i mechanizmy molekularne, które odgrywają kluczową rolę w odpowiedzi na trening oporowy, a także przyczyniają się do zaniku mięśni po urazach, unieruchomieniu czy długim okresie bezczynności. Jednym z głównych regulatorów syntezy białek w mięśniach szkieletowych jest szlak sygnałowy mTOR, który aktywuje się w odpowiedzi na ćwiczenia oporowe i/lub spożycie białka, wspierając procesy prowadzące do hipertrofii mięśni. Z kolei jego zmniejszona aktywność, spowodowana np. unieruchomieniem po urazie, prowadzi do obniżenia syntezy białek i zaburzenia równowagi między syntezą a rozpadem białek mięśniowych, co skutkuje utratą masy mięśniowej. Innym istotnym czynnikiem wpływającym na ten proces jest miostatyna, która działa jako negatywny regulator masy mięśniowej, hamując szlaki odpowiedzialne za ich wzrost. Miostatyna jest produkowana w mięśniach szkieletowych, a następnie wydzielana do osocza, gdzie wiąże się z receptorami komórek mięśniowych, uruchamiając kaskadę reakcji sygnałowych, które ograniczają wzrost mięśni. Podwyższony poziom miostatyny prowadzi do hamowania fosforylacji i aktywacji kinazy białkowej B (Akt), co skutkuje nasileniem rozpadu białek mięśniowych oraz zmniejszeniem aktywności szlaku mTOR. Poza mTOR, w rozpadzie białek mięśniowych kluczową rolę odgrywa również aktywacja szlaku ubikwityny przez miostatynę. Wzrost jej aktywności powoduje translokację czynników transkrypcyjnych FOXO do jądra komórkowego, co sprzyja ekspresji genów odpowiedzialnych za degradację białek mięśniowych, takich jak MuRF1 i MAFbx. Te ligazy ubikwityny E3 prowadzą do oznaczania białek mięśniowych, kierując je do degradacji i przyspieszając proces rozpadu. Ponadto, miostatyna ogranicza proliferację i różnicowanie komórek satelitarnych, które pełnią funkcję komórek macierzystych mięśni. Komórki te pozostają w stanie uśpienia, ale są aktywowane w odpowiedzi na uraz lub ćwiczenia w celu naprawy i regeneracji mięśni. Ich ograniczona liczba może przyczyniać się do obniżenia jakości mięśni poprzez zwiększenie ilości tkanki włóknistej i odkładanie tłuszczu, a także wywoływać wzrost poziomu cytokin zapalnych w organizmie. Podwyższony stan zapalny, obserwowany np. po rekonstrukcji więzadła krzyżowego przedniego, wiąże się ze wzrostem poziomu markerów zapalnych, takich jak TGF-β, który może bezpośrednio indukować proces zaniku mięśni. Podobne mechanizmy występują również w przypadku innych urazów stawów, gdzie stan zapalny rozprzestrzenia się na otaczającą muskulaturę. Spadek syntezy białek mięśniowych, a w konsekwencji zanik mięśni, może być efektem przewlekłego stanu zapalnego wynikającego z urazu lub interwencji chirurgicznej. Chociaż badania w tym zakresie są ograniczone, procesy zapalne towarzyszące urazom i operacjom, takim jak rekonstrukcja ACL, wymagają dalszych analiz, ponieważ nie można ich w pełni odwzorować w eksperymentalnych modelach zaniku mięśni spowodowanego nieużywaniem [14-19].
 Ultra Fish Oil od Apollo’s Hegemony – źródło niezbędnych kwasów tłuszczowych wspierających rekonwalescencję – KUP TUTAJ
Ultra Fish Oil od Apollo’s Hegemony – źródło niezbędnych kwasów tłuszczowych wspierających rekonwalescencję – KUP TUTAJ
Rola żywienia
Liczne badania potwierdzają rolę wsparcia żywieniowego, w tym suplementacji, w utrzymaniu i zwiększaniu masy mięśniowej. Choć głównie dotyczy to hipertrofii mięśni w odpowiedzi na trening oporowy, strategie te mogą być kluczowe w przeciwdziałaniu zanikowi mięśni po urazach układu mięśniowo-szkieletowego, szczególnie po rekonstrukcji więzadła krzyżowego przedniego (ACL). Istotną rolę w regulacji syntezy białek mięśniowych odgrywa mTOR, integrujący sygnały z różnych źródeł.Suplementacja wspiera hipertrofię mięśni trzema głównymi mechanizmami:
– Bezpośrednio wpływa na syntezę białek mięśniowych.
– Zwiększa zdolność do intensywniejszego treningu w odpowiedniej fazie rehabilitacji.
– Stymuluje proliferację i różnicowanie komórek satelitarnych.
Na przykład kreatyna wspiera hipertrofię poprzez zwiększenie poziomu fosfokreatyny, co pozwala na szybszą regenerację ATP i intensywniejszy trening. Dodatkowo może stymulować mTOR oraz proliferację komórek satelitarnych. Kofeina jako stymulant ośrodkowego układu nerwowego zmniejsza percepcję wysiłku, umożliwiając cięższy trening w późniejszych fazach rehabilitacji. Po urazie ACL dochodzi do zahamowania procesów hipertroficznych, co sprzyja zanikowi mięśni. Kluczowym aspektem rekonwalescencji jest dostępność energii, definiowana jako energia pozostała na utrzymanie funkcji organizmu po odjęciu kosztów aktywności fizycznej. Niedobór energetyczny może wynikać z ograniczenia spożycia kalorii, zwiększonego kosztu ćwiczeń lub obu tych czynników. Intuicyjna redukcja spożycia energii po urazie, w celu uniknięcia przyrostu masy ciała, może być niewłaściwa, zwłaszcza że proces gojenia wymaga dodatkowej energii. Badania wskazują, że deficyt energetyczny rzędu 20% może prowadzić do redukcji syntezy białek mięśniowych o 16%, nawet przy umiarkowanym spożyciu białka. Jednak trening oporowy i spożycie 15–30 g białka po ćwiczeniach mogą przywrócić syntezę białek do poziomu równowagi energetycznej, a nawet ją zwiększyć. Odpowiednie spożycie węglowodanów również ma istotne znaczenie. Ich ograniczenie może zwiększać utlenianie białek i hamować przerost mięśni, co jest niekorzystne w rehabilitacji. Białko jest kluczowym makroskładnikiem dla zdrowia mięśni. Zalecana dzienna dawka wynosi 0,8 g/kg masy ciała, jednak u sportowców może sięgać 2,0 g/kg/dzień, aby wspierać regenerację i adaptację metaboliczną. Spożycie aminokwasów zwiększa syntezę białek mięśniowych, zwłaszcza w połączeniu z treningiem oporowym. Hipoteza „wyzwalacza leucyny” sugeruje, że ilość leucyny i jej stężenie we krwi determinują wielkość odpowiedzi anabolicznej po treningu. Strategie optymalizacji spożycia białka obejmują jego odpowiednią ilość, jakość i czas podania. W kontekście urazów ACL, istotne jest dostosowanie suplementacji do specyficznych potrzeb rehabilitacji. Obejmuje to stosowanie źródeł bogatych w leucynę, odpowiednią dystrybucję białka w ciągu dnia oraz włączenie aminokwasów egzogennych i ich pochodnych. Zastosowanie tych strategii może skutkować lepszymi efektami odbudowy masy mięśniowej i siły po urazie [1]. Przechodząc do suplementacji, kreatyna to dobrze przebadany suplement, który w połączeniu z treningiem oporowym zwiększa hipertrofię mięśni poprzez poprawę wydajności wysiłku o wysokiej intensywności. Działa głównie jako donor fosforanu, wspierając szybką regenerację ATP. Może także wpływać na sygnalizację anaboliczną i proliferację komórek satelitarnych. Wspomaga regenerację i zachowanie masy mięśniowej, co jest istotne w rehabilitacji. Kwasy omega-3 wykazują potencjał w redukcji stanu zapalnego i mogą wspierać syntezę białek mięśniowych, choć wyniki badań są niejednoznaczne. Kolagen odgrywa kluczową rolę w strukturze mięśni i ścięgien, ale jego wpływ na syntezę białek mięśniowych jest mieszany. Może wspomagać regenerację i przekazywanie siły w ścięgnach, jednak wymaga dalszych badań, zwłaszcza w kontekście rehabilitacji po urazach. Kofeina jest najczęściej spożywanym suplementem na świecie i szeroko badanym środkiem poprawiającym wydolność w sportach wytrzymałościowych, zespołowych i o wysokiej intensywności. Działa jako antagonista receptorów adenozynowych, zwiększając motywację, zmniejszając odczuwanie bólu i zmęczenia, co pozwala na większą objętość treningową. Choć kofeina nie wpływa bezpośrednio na syntezę białek mięśniowych, może pośrednio wspierać hipertrofię poprzez zwiększenie obciążenia treningowego. Może to być szczególnie istotne w późnych fazach rehabilitacji po rekonstrukcji ACL, pomagając odzyskać siłę i masę mięśniową. Optymalizacja strategii suplementacji w regeneracji po urazach nadal stanowi obszar badań. Niektóre badania sugerują, że łączenie białka z węglowodanami może wspierać przyrost masy mięśniowej i siły, szczególnie po urazie ACL lub okresach unieruchomienia. W jednym z badań 12-tygodniowy program treningowy u osób po urazie ACL wykazał większą hipertrofię mięśni czworogłowych po spożywaniu aminokwasów egzogennych z węglowodanami niż samych węglowodanów lub placebo. Inne badania na zdrowych osobach miały mieszane wyniki, co może wynikać z różnic w czasie trwania interwencji. Badania wskazują, że efekt połączenia aminokwasów i węglowodanów jest sumą ich niezależnych efektów, co sugeruje konieczność dalszej analizy synergii i potencjalnych interakcji między suplementami [1].
Literatura:
[1] Smith MJ, Hoffman NJ, Jose AJS, Burke LM, Opar DA. Nutritional Interventions to Attenuate Quadriceps Muscle Deficits following Anterior Cruciate Ligament Injury and Reconstruction. Sports Med. 2025 Jan 24
[2] Sonnery-Cottet B, Saithna A, Quelard B, Daggett M, Borade A, Ouanezar H, et al. Arthrogenic muscle inhibition after ACL reconstruction: a scoping review of the efficacy of interventions. Br J Sports Med [Internet]. 2019;53(5):289 LP–298. http:// bjsm. bmj. com/ conte nt/ 53/5/ 289. abstr act.
[3] Urbach D, Nebelung W, Weiler HT, Awiszus F. Bilateral deficit of voluntary quadriceps muscle activation after unilateral ACL tear. Med Sci Sports Exerc. 1999;31(12):1691–6.
[4] Rice DA, McNair PJ. Quadriceps arthrogenic muscle inhibition: neural mechanisms and treatment perspectives. Semin Arthritis Rheum. 2010;40(3):250–66.
[5] McPherson AL, Schilaty ND, Anderson S, Nagai T, Bates NA. Arthrogenic muscle inhibition after anterior cruciate ligament injury: injured and uninjured limb recovery over time. Front Sport Act Living [Internet]. 2023. https:// doi. org/ 10. 3389/ fspor. 2023. 11433 76.
[6] Fyfe JJ, Opar DA, Williams MD, Shield AJ. The role of neu- romuscular inhibition in hamstring strain injury recurrence. J Electromyogr Kinesiol. 2013;23(3):523–30.
[7] Lim C, Nunes EA, Currier BS, McLeod JC, Thomas ACQ, Phil- lips SM. An evidence-based narrative review of mechanisms of resistance exercise-induced human skeletal muscle hypertrophy. Med Sci Sports Exerc. 2022;54(9):1546–59.
[8] Yin L, Li N, Jia W, Wang N, Liang M, Yang X, et al. Skeletal muscle atrophy: from mechanisms to treatments. Pharmacol Res. 2021;172: 105807.
[9] Flosadottir V, Roos EM, Ageberg E. Muscle function is asso- ciated with future patient-reported outcomes in young adults with ACL injury. BMJ Open Sport Exerc Med [Internet]. 2016;2(1):e000154. http:// bmjop ensem. bmj. com/ conte nt/2/ 1/ e0001 54. abstr act.
[10] Wiggins AJ, Grandhi RK, Schneider DK, Stanfield D, Webster KE, Myer GD. Risk of secondary injury in younger athletes after anterior cruciate ligament reconstruction: a systematic review and meta-analysis. Am J Sports Med. 2016;44(7):1861–76.
[11] Filbay SR, Grindem H. Evidence-based recommendations for the management of anterior cruciate ligament (ACL) rupture. Best Pract Res Clin Rheumatol. 2019;33(1):33–47.
[12] Tsoukas D, Fotopoulos V, Basdekis G, Makridis KG. No differ- ence in osteoarthritis after surgical and non-surgical treatment of ACL-injured knees after 10 years. Knee Surg Sport Traumatol Arthrosc [Internet]. 2016;24(9):2953–9. https:// doi. org/ 10. 1007/ s00167- 015- 3593-9.
[13] Grindem H, Eitzen I, Engebretsen L, Snyder-Mackler L, Risberg MA. Nonsurgical or surgical treatment of acl injuries: knee func- tion, sports participation, and knee reinjury: the Delaware-Oslo ACL cohort study. JBJS [Internet]. 2014;96(15).
[14] Bamman MM, Ferrando AA, Evans RP, Stec MJ, Kelly NA, Gruenwald JM, et al. Muscle inflammation susceptibility: a prog- nostic index of recovery potential after hip arthroplasty? Am J Physiol Endocrinol Metab. 2015;308(8):E670–9.
[15] Drummer DJ, McAdam JS, Seay R, Aban I, Lavin KM, Wig- gins D, et al. Perioperative assessment of muscle inflammation susceptibility in patients with end-stage osteoarthritis. J Appl Physiol. 2022;132(4):984–94.
[16] Ji Y, Li M, Chang M, Liu R, Qiu J, Wang K, et al. Inflammation: roles in skeletal muscle atrophy. Antioxidants (Basel, Switzer- land). 2022;11(9):1686–709.
[17] Pavis GF, Abdelrahman DR, Murton AJ, Wall BT, Stephens FB, Dirks ML. Short-term disuse does not affect postabsorp- tive or postprandial muscle protein fractional breakdown rates. J Cachexia Sarcopenia Muscle. 2023;14(5):2064–75.
[18] Brook MS, Stokes T, Gorissen SHM, Bass JJ, McGlory C, Cegielski J, et al. Declines in muscle protein synthesis account for short-term muscle disuse atrophy in humans in the absence of increased muscle protein breakdown. J Cachexia Sarcopenia Muscle. 2022;13(4):2005–16.
[19] Cuthbertson D, Smith K, Babraj J, Leese G, Waddell T, Atherton P, et al. Anabolic signaling deficits underlie amino acid resist- ance of wasting, aging muscle. FASEB J. 2005;19(3):422–4.